
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:惠安惠南中学2007届高三第一学期期末考试化学试卷-新人教 题型:022
用硫酸处理铁悄所得到的溶液A中除Fe2+外,还含有一定量的Fe3+、Cu2+和Mn2+.今用A溶液制取硫酸亚铁晶体,并测定该晶体中结晶水的含量,实验方案如下:
实验1:制取硫酸亚铁晶体的过程如下图:
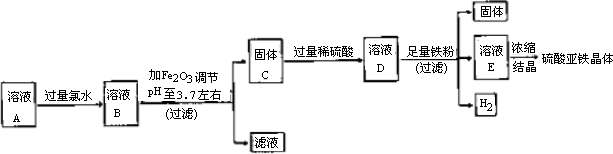
(1)往溶液A中加过量氯水的作用是________.
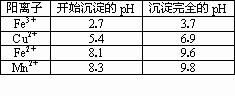
(2)右表是使一些金属离子转化为氢氧化物沉淀的pH,根据表中数据分析,固体C是________.
(3)有人提出,在处理溶液B时,先加入几滴石蕊试液,然后逐滴加入NaOH溶液至溶液恰好由红色变为紫色(pH约为5),过滤即可得到固体C,你认为此方案是否可行?________(填“行”或“不行”),其理由是________.
实验2:用下图装置进行测定硫酸亚铁晶体(FeSO4·nH2O)中结晶水含量的实验(图中半透膜可让气体通过又可防止固体粉末进入导管):将m1 g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水,冷却至常温后,称量玻璃管中固体的质量为m2 g.
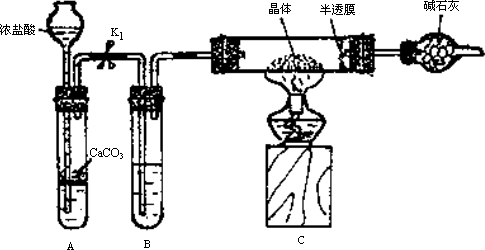
(1)B中的试剂是________.
(2)实验中有以下步骤:
①打开K1
②关闭K1
③点燃酒精灯
④熄灭酒精灯火焰,使C中玻璃管冷却至常温.
正确的实验操作顺序是________(填以上选项序号).
(3)根据实验结果,计算硫酸亚铁晶体中结晶水的n值为________.
(摩尔质量:FeSO4为152 g·mol-1;H2O为18 g·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com