
分析 氧化还原反应中得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,根据元素化合价变化标出电子转移的方向和数目,由此分析解答.
解答 解:(1)该反应中,硝酸得电子作氧化剂,铜失电子作还原剂,铜对应的产物硝酸铜是氧化产物,该反应中铜失去电子数=3(2-0)=6,硝酸得电子数=2(5-2)=6,所以用双线桥法在化学方程式中表示出电子转移的方向和数目为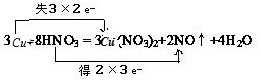 ,
,
①被氧化的元素是铜,被还原的元素是氮,
故答案为:铜;氮;
②氧化剂是硝酸,还原剂是铜,
故答案为:硝酸;铜;
③铜发生氧化反应,硝酸发生还原反应,
故答案为:铜;硝酸;
④若有5.6L(标准状况)NO的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成1mol的一氧化氮转移3mol的电子,则转移的电子物质的量是0.75mol,被还原的硝酸为0.25mol,
故答案为:0.75;0.25.
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,氯酸钾中Cl元素化合价降低,盐酸中Cl元素化合价升高,化合价降低值=化合价升高值=转移电子数=5,电子转移方向和数目为: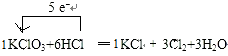 ,反应中还原产物和氧化产物的物质的量之比为1:5;
,反应中还原产物和氧化产物的物质的量之比为1:5;
故答案为: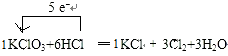 ;C.
;C.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意从化合价的角度及电子守恒角度解答该题,难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 | |
| B. | 由于燃烧反应放热,所以△H1和△H2均取正值 | |
| C. | 由于石墨和金刚石同为碳元素组成,所以△H1=△H2 | |
| D. | 由于燃烧均为放热反应,所以石墨为重要的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、乙醇、苯乙烯 | |
| B. | 将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(R+)>c(H+)>c(OH-) | B. | c(A-)>c(R+)>c(OH-)>c(H+) | ||
| C. | c(R+)>c(A-)>c(H+)>c(OH-) | D. | c(R+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
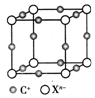 前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com