
【题目】某工厂废料中含有一定量的单质银。该工厂设计回收单质银的工艺流程如下:

已知:
i.NaClO在酸性条件下易分解,且NaClO氧化Ag的效果远强于NaClO3;
ii.3NaClO![]() 2NaCl+NaClO3。
2NaCl+NaClO3。
请回答下列问题:
(1)“粉碎”的目的为___。
(2)“浸出”时,需加入适量NaCl并保持体系为碱性环境,其中需保持体系为碱性环境的原因为___,发生反应的离子方程式为___。
(3)“浸出”时,所加NaClO可用代替___ (填选项字母),但此法的缺点是___。
A.HNO3 B.NaCl C.Na2S
(4)“溶解”时,发生反应的离子方程式为___。
(5)“还原”时,N2H4·H2O对应的产物为N2。此反应中氧化剂与还原剂的物质的量之比为___。
【答案】增大接触面积,提高后续银的浸出速率 防止NaClO分解成NaCIO3降低氧化效果 2Ag+ClO+Cl+H2O=2AgCl+2OH A 产生氮氧化物,污染环境 AgCl+2NH3H2O=[Ag(NH3)2]++Cl+2H2O 4:1
【解析】
(1)“粉碎”的目的为增大接触面积,提高后续银的浸出速率;
(2)保持体系为碱性环境,为防止NaClO分解成NaClO3降低氧化效果;
(3)“浸出”时需要氧化剂,所加NaClO可用HNO3代替,但产生氮氧化物;
(4)“溶解”时,根据反应物和产物的判断可得发生反应的离子方程式为AgCl+2NH3H2O=[Ag(NH3)2]++Cl-+2H2O;
(5)“还原”时,N2H4H2O对应的产物为N2,转移电子数为4,氧化剂为+1价的银,转移电子数为1。
(1)“粉碎”的目的为增大接触面积,提高后续银的浸出速率;
(2)“浸出”时,需加人适量NaClO并保持体系为碱性环境,其中需保持体系为碱性环境的原因为防止NaClO分解成NaClO3降低氧化效果,发生反应的离子方程式为2Ag+ClO+Cl+H2O=2AgCl+2OH;
(3)“浸出”时需要氧化剂,所加NaClO可用HNO3代替,但此法的缺点是产生氮氧化物,污染环境;
(4)“溶解”时,根据反应物和产物的判断可得发生反应的离子方程式为AgCl+2NH3H2O=[Ag(NH3)2]++Cl+2H2O;
(5)“还原”时,N2H4H2O对应的产物为N2,转移电子数为4,氧化剂为+1价的银,转移电子数为1,所以氧化剂与还原剂的物质的量之比为4:1。


科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
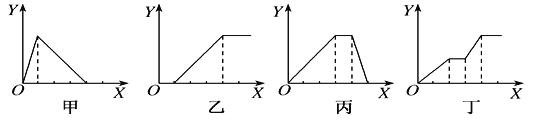
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是

A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
D.如果将稀硫酸换成醋酸,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3.60gNaCl、NaHCO3和Na2CO3的混合固体,加热足够长时间后,固体质量剩余3.29g;将剩余固体溶于一定体积的盐酸中,产生0.448L气体(标准状况下),并将所得溶液稀释至100mL,测得所得溶液pH=1。下列判断正确的是( )
A.混合固体中NaHCO3的质量为0.84g
B.混合固体中Na2CO3的质量为2.12g
C.所加盐酸中,HCl的物质的量为0.04mol
D.最终所得溶液中c(Cl-)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
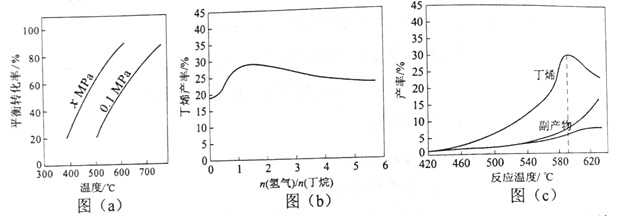
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取硝基苯的主要步骤如下:
①将配制好的浓硫酸与浓硝酸的混合酸,冷却后加入试管中。
②向混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③水浴加热发生反应。
④反应结束后,待混合液冷却后转移至分液漏斗中,除去混合酸,粗产品依次用蒸馏水和10%的Na2CO3溶液洗涤,再用蒸馏水洗涤,得粗硝基苯。
⑤将粗硝基苯用无水CaCl2干燥后蒸馏得到纯硝基苯。

回答下列问题:
(1)配制一定比例浓硫酸和浓硝酸的混合酸的操作是___。
(2)步骤③中,水浴加热的优点是___。
(3)图中长玻璃导管的作用是___。
(4)写出制取硝基苯的化学方程式:___。
(5)步骤④中粗产品用10%的Na2CO3溶液洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。下列说法正确的是
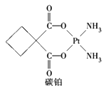
A. 碳铂中所有碳原子在同一个平面中
B. 1 mol 碳铂含有σ键的数目为26NA
C. [Pt(NH3)2Cl2]有顺式和反式两种结构,是一种复盐
D. 碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com