
分析 (1)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称;核素是指具有一定数目质子和一定数目中子的一种原子;原子符号左上角的数字为质量数;
(2)根据原子符号的含义以及阳离子中质子数=核外电子数-电荷数,质量数=质子数+中子数;
(3)先计算该微粒中的电子数、质子数、中子数,然后比较.
解答 解:(1)元素的种类由质子数决定,质子数不同,元素的种类就不同,1H、2H、3H、1H+;234U、235U、238U;40K;40Ca;Cl2;14N;14C分别属于H、U、K、Ca、Cl、N、C等7种元素;1H、2H、3H是氢元素的三种核素,即氢元素的核素有3种;234U、235U、238U等属于釉元素,即釉元素的核素有3种;1H、1H+的质量数均为1,14N、14C的质量数均为14,即质量数相等的为1H、1H+,14N、14C.故答案为:7;3;3;1H、1H+,14N、14C;
(2)化合物中R元素的微粒的电子数为Z+X,故质子数=Z+X,质量数=质子数+中子数=Z+X+Y,所以该同位素的符号是Y+X+ZZ+XR,故答案为:Y+X+ZZ+XR;
(3)在H3O+中,质子数、中子数、电子数分别为11、8、10,故个数之比为:11:8:10;在NH3D+中电子数为:7+3×1+1-1=10,质子数为7+3×1+1=11;
H没有中子,所以该微粒的中子数为7+3×0+1=8,所以其比为10:11:8.
故答案为:11:8:10;10:11:8.
点评 注意微粒中核内质子数、核外电子数、所带电荷数的关系:1、阳离子的核内质子数=其核外电子数+所带电荷数;2、阴离子的核内质子数=其核外电子数-所带电荷数.


科目:高中化学 来源: 题型:选择题
| A. | NaCl Na2SO4 | B. | NaCl NaBr Na2SO4 | ||
| C. | NaCl Na2SO4 I2 | D. | NaCl NaI Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
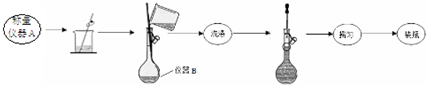
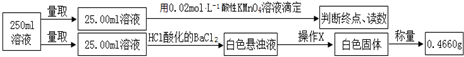
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1molHCl气体时放出|△H1|热量 | |
| D. | 1molHBr(g)具有的能量小于1molHBr(l)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 氧化还原的本质是元素化合价的升降 | |
| C. | 失电子越多,该物质的还原性就越强 | |
| D. | 金属单质在化学反应中一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
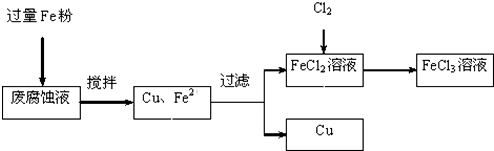
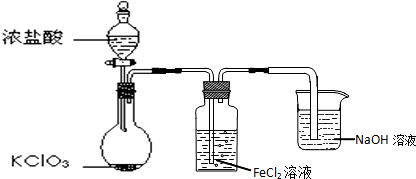
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com