
| A. | 硅可用作半导体材料 | |
| B. | 明矾可用作净水剂 | |
| C. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| D. | 煤是一种清洁能源,直接燃烧不会造成环境污染 |
分析 A.Si属于半导体,据此来确定其用途;
B.明矾可用作净水剂,是因为明矾与水反应生成氢氧化铝胶体;
C.“铁红”化学式为Fe2O3;
D.煤中含有硫氮等元素.
解答 解:A.Si属于半导体,是重要的半导体材料,故A正确;
B.明矾可用作净水剂,是因为明矾与水反应生成氢氧化铝胶体,故B正确;
C..“铁红”化学式为Fe2O3,是红色油漆的重要原料,故C正确;
D煤是一种常用的燃料,由于煤燃烧产生的废气含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,故D错误.
故选D.
点评 本题考查硅在自然界中的存在形式以及硅和二氧化硅的性质和用途等,较简单,注意元素的存在与性质的关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 和
和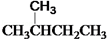 ⑦
⑦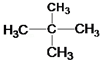 和 CH3CH2CH2CH3
和 CH3CH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
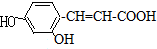 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
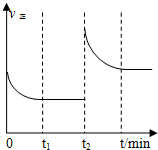 一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
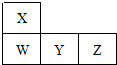
| A. | 元素Y位于元素周期表的第三周期ⅥA族 | |
| B. | 原子半径的大小顺序为:rW>rY>rZ | |
| C. | 元素Y的最高价氧化物对应水化物的酸性比Z的强 | |
| D. | 元素W的气态简单氢化物的热稳定性比X的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
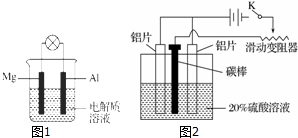
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液的本质区别是胶体粒子的直径1-100 nm | |
| B. | 胶体粒子很小,能透过半透膜 | |
| C. | 向氢氧化铁胶体中滴加盐酸,可能的现象是先产生红褐色沉淀,后沉淀逐渐溶解 | |
| D. | 雾是气溶胶,在阳光的照射下可见到丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
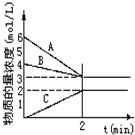 已知N2+3H2$?_{加热}^{催化剂}$2NH3+Q,根据图判断:
已知N2+3H2$?_{加热}^{催化剂}$2NH3+Q,根据图判断:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com