
【题目】将等物质的量浓度、等体积的硫酸与烧碱溶液混合后,滴入紫色石蕊试液,溶液呈( )
A.紫色B.红色C.蓝色D.无色
科目:高中化学 来源: 题型:
【题目】一定温度条件下,N2与H2反应生成NH3的过程中能量变化曲线如下图。

(1)曲线_______(填“a“或“b”")是加入催化剂时的能量变化曲线, N≡N键能为946kJ/mol,N-H键能为391kJ/mol,则H-H建能为_______kJ/mol。
(2)水的自偶电离方程式为2H2O![]() H3O++OH-,液氨也能发生自偶电离,写出液氨的自偶电离方程反应过程式_________;NH2-电子式为________。
H3O++OH-,液氨也能发生自偶电离,写出液氨的自偶电离方程反应过程式_________;NH2-电子式为________。
(3)次氯酸钠溶液中离子浓度由大到小顺序为________;将氨气通入到次氯酸钠溶液中可制得联氨(N2H4),写出反应的离子方程式__________;用四氧化二氮作助燃剂,联氨可作火箭燃料。已知:N2(g)+2O2(g)= 2NO2(g),ΔH,= +67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;N2O4(g)=2NO2(g),ΔH3=+ 57kJ/mol,写出气态的联氨在四氧化二氮气体中燃烧生成两种无污染气态产物的热化学方程式______。
(4)将2.04mol/L的氨水与0.02mo/L的硝酸银溶液等体积混合得到混合溶液,混合体系中存在平衡:Ag+(aq) +2NH3·H2O(aq) ![]() Ag(NH3)2+(aq)+2H2O(1),平衡常数表达式K=_________;在常温时K=1×107,由于氨水过量,银离子几乎反应完全,计算此时混合溶液中c(Ag+)=_________mol/ L。
Ag(NH3)2+(aq)+2H2O(1),平衡常数表达式K=_________;在常温时K=1×107,由于氨水过量,银离子几乎反应完全,计算此时混合溶液中c(Ag+)=_________mol/ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯分子中的化学键描述正确的是( )
A. 每个碳原子的sp2杂化轨道中的其中一个形成大π键
B. 每个碳原子的未参加杂化的2p轨道形成大π键
C. 碳原子的三个sp2杂化轨道与其他形成两个σ键
D. 碳原子的未参加杂化的2p轨道与其他形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是 ( )

A. 电池工作时,CO32-向电极B移动
B. 电极A上H2参与的电极反应为:H2 +2e- +2OH- = 2H2O
C. 电极B上发生的电极反应为:1/2O2+2e- + CO2 = CO32-
D. 反应CH4 + H2O= 3H2 + CO,每消耗1molCH4转移12mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是( )
A.FeCl3溶液有杀菌消毒作用
B.FeCl3溶液能使血液聚集沉降
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3能使血液发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质特殊聚集状态结构的叙述中,错误的是( )
A.等离子体的基本构成微粒的排列是带电的离子和电子及不带电的分子或原子
B.非晶体基本构成微粒的排列是长程无序和短程有序的
C.液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性
D.纳米材料包括纳米颗粒与颗粒间的界面两部分,两部分都是长程有序的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素是非常重要的非金属元素,其单质和化合物有广泛用途,化学性质也非常丰富。
(1)基态氯原子的价电子排布式为__________________,其核外电子占据的最高能层的符号是_________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是___________。
(3)ClO2—的立体结构为_______形,中心氯原子的杂化轨道类型为_________,写出ClO2—一个等电子体的化学式 ______。
(4)下列分子中只存在s-p![]() 键的是_____________。
键的是_____________。
A. H2 B.F2 C.HCl D.HClO
(5)CsICl2不稳定,受热时可能按下列两种方式分解,已知生成物晶格能越大反应越易发生,则CsICl2按下列______方式分解更合理。
A.CsICl2=CsI+Cl2 B. CsICl2=CsCl+ICl
(6)由F、K、Mg三种元素形成的某离子晶体的晶胞结构如下图所示,晶胞边长为a nm(1nm=10—9m)。
①该晶体的化学式为___________________。
②该晶体的密度为____________gcm—3。(结果保留1位小数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
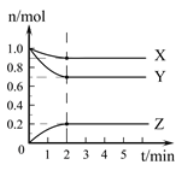
(1)反应开始至2 mim,Y的平均反应速率_________。
(2)分析有关数据,写出X、Y、Z的反应方程式______________________________。
(3)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com