
下列反应的离子方程式不正确的是
A.碳酸氢钙溶液加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++OH-=NH3·H2O
C.在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色:5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4— + 2H2O
D.等体积同浓度NaHSO4、Ba(OH)2两溶液混合:H++SO42—+Ba2++OH—=BaSO4↓+H2O
B
【解析】
试题分析:A、碳酸氢钙溶液加入过量的氢氧化钙溶液生成碳酸钙和水,离子方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O,A正确;B、等物质的量的NH4HCO3与NaOH在溶液中反应生成碳酸钠、碳酸铵和水,离子方程式为HCO3-+OH-=CO32-+H2O,B错误;C、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色说明Mn2+被氧化生成了MnO4— ,则离子方程式为5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4— + 2H2O,C正确;D、等体积同浓度NaHSO4、Ba(OH)2两溶液混合生成硫酸钡、氢氧化钠和水,离子方程式为H++SO42—+Ba2++OH—=BaSO4↓+H2O,D正确,答案选B。
考点:考查离子方程式正误判断


科目:高中化学 来源:2014-2015学年山东省济宁市高三上学期期中化学试卷(解析版) 题型:选择题
准确配制一定物质的量浓度的NaOH溶液,下面实验操作中不正确的是
A.用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中
B.将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中
C.定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切
D.将称好的NaOH固体放入烧杯中,加入适量水溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是

A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系
B.当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:选择题
下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | 实验室常用Al2(SO4)3溶液与氨水溶液制备Al(OH)3沉淀 | Al(OH)3不溶于碱 |
B | NaHCO3为强碱弱酸盐 | NaHCO3 溶液显碱性 |
C | SO2具有氧化性 | SO2可用品红溶液检验 |
D | Fe(OH)3胶体有丁达尔效应 | Fe(OH)3胶体可以用FeCl3浓溶液与NaOH溶液反应制得 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性
B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
下列有关化学实验的叙述正确的是
A.用待测液润洗滴定用的锥形瓶
B.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
C.用稀硝酸酸洗涤盛做过银镜反应的试管
D.液溴保存时液面覆盖一层水,装在带橡胶塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2 (g)+3H2 (g)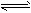 2NH3 (g),△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3 (g),△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器②中达平衡时放出的热量Q=23. 15kJ
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0.5L,则平衡时放出的热量小于23. 15kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
氮化碳结构如下图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。
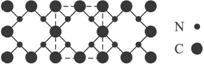
下列有关氮化碳的说法不正确的是
A.氮化碳属于原子晶体
B.氮化碳中碳显—4价,氮显+3价
C.氮化碳的化学式为:C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)(1)已知某反应的平衡常数表达式为:K= ,则它所对应反应的化学方程式是 。
,则它所对应反应的化学方程式是 。
(2)合成甲醇的主要反应是:2H2(g)+CO(g)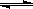 CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(A)该时间段内反应速率v(H2)=
(B)比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(C)反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向
(填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com