
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42-和NO3﹣的相互分离。相应的实验过程可用下图表示:
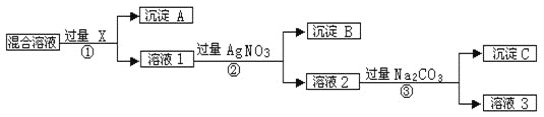
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___________,沉淀C______________。
(2)按此实验方案得到的溶液3中肯定含有杂质;为了解决这个问题,可以向溶液3中加入适量的____________。
(3)上述实验流程中加入过量的AgNO3,确认AgNO3已过量的实验方法是________________________。
(4)写出步骤①中发生反应的离子方程式是__________________________________。
【答案】BaCl2 或 Ba(NO3)2 Ag2CO3 和 BaCO3 HNO3 静置取上层清液继续滴加AgNO3溶液,若无沉淀则证明AgNO3溶液过量 Ba2++SO42-=BaSO4↓
【解析】
试题(1)Cl-用Ag+除去,SO42-用Ba2+除去,除杂分离不能引入新杂质,过量Ba2+、Ag+必须除去,根据实验过程,X为BaCl2或Ba(NO3)2,沉淀A为BaSO4;(2)根据实验过程,溶液1溶质为BaCl2或Ba(NO3)2、NaCl、NaNO3,②中加入AgNO3溶液,沉淀B为AgCl,溶液2溶质为NaNO3、Ba(NO3)2、NaNO3,反应③中加入过量的Na2CO3,沉淀C为BaCO3、AgCO3,溶液3为Na2CO3、NaNO3;(3)根据上述分析,Na2CO3作用除去过量的Ba2+、Ag+,确认Na2CO3过量操作:取少量溶液,置于试管中,向溶液中加入BaCl2溶液或盐酸,产生沉淀或气泡,则说明Na2CO3过量;(4)反应①中发生的反应Ba2++SO42-=BaSO4↓。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A. 该反应是吸热反应
B. 该反应是放热反应
C. 铁粉和硫粉在常温下可以发生反应
D. 硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
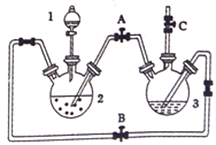
(1)稀硫酸应放在_____________(填写仪器名称)中。
(2)本实验通过关闭开关________、打开开关_________,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为______________。滴定终点的现象是__________________________。通过实验数据计算的该产品纯度为_____________(用字母a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为负极。A、B、C三种金属的活动性顺序为
A.A>B>CB.A>C>BC.B>A>CD.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A. 4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
B. 2Fe+2H2O+O2===2Fe(OH)2↓
C. 2H2O+O2+4e-===4OH-
D. Fe-3e-===Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色、澄清溶液中可能含有①Na+、②SO![]() 、③Cl-、④HCO3-、⑤CO
、③Cl-、④HCO3-、⑤CO![]() 、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用紫色石蕊试液检验 | 溶液变红 |
(2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
(3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
下列结论正确的是
A.肯定含有的离子是②③⑥
B.该实验无法确定是否含有③
C.可能含有的离子是①③⑦
D.肯定没有的离子是④⑤,可能含有的离子是②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,且A、C同周期,B和C同主族;A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30;D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)C元素的元素符号为________;
(2)B、D元素的第一电离能大小关系为:B_____D(填“<”、“>”或“=”);
(3)写出D元素形成的单质的结构式为______________,其中σ键:π键=______。
(4)A2B对应的水化物的碱性比LiOH _______(填“强”或“弱”);化合物A2B2属于_______(选“离子”或“共价”)化合物,写出A2B2的电子式_________________,A2B2溶于水时发生反应的化学方程式为__________________________________________________
(5)化合物E2B、E2C,它们结构与组成相似,热稳定性更强的是__________(填化学式)
但E2B的沸点比E2C高得多的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属混合物3.4g,与足量的盐酸反应放出H22.24L(标况下),这两种金属可能是
A. 铜和铁 B. 镁和铝 C. 锌和铝 D. 锌和铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com