
【题目】铜是人类利用最早的金属之一,其单质及化合物在人生产生活中有着广泛的应用。
(1)铜可以做成导线,Cu的焰色为___________色;基态Cu2+的核外电子占据的最高能层的能层符号为___________。
(2)铜可以作为乙醇和氧气反应的催化剂,2CH3CH2OH + O2![]() CH3CHO + 2H2O。写出与水具有相同空间构型的一个分子和一个离子______________(微粒由短周期元素组成)。从原子轨道重叠方式来看CH3CHO中所含的共价键类型有____________________,碳的杂化方式是______________。
CH3CHO + 2H2O。写出与水具有相同空间构型的一个分子和一个离子______________(微粒由短周期元素组成)。从原子轨道重叠方式来看CH3CHO中所含的共价键类型有____________________,碳的杂化方式是______________。
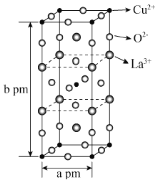
(3)高温超导是世界上最前沿的研究之一,如下图是第一个被发现的高温超导体氧化物的晶胞。该化合物的化学式为___________。与Cu2+紧邻的O2-的个数为___________。已知,阿伏加德罗常数为NA,则晶胞密度为___________g·cm-3。
【答案】绿色 M H2S或SO2,NO![]() 或NH
或NH![]() σ键和π键 sp2和sp3杂化 La2CuO4 6
σ键和π键 sp2和sp3杂化 La2CuO4 6 ![]()
【解析】
根据各元素的焰色反应颜色确定铜的焰色反应的颜色,写出铜的核外电子排布式,确定最高能层的符号;根据水分子的价层电子对数确定分子的立体构型,通过同族替换等方法找到分子立体构型相同的分子或原子;根据乙醛的分子结构确定共价键的类型和杂化方式;利用均摊法找出La、Cu、O原子的个数,得出分子式,根据图示找出铜离子的配位数,利用![]() 进行计算。
进行计算。
(1) Cu的焰色为绿色;基态Cu2+的核外电子排布式为1s22s22p63s23p63d9,占据的最高能层的能层符号为M;
(2)水的成键电子对数为2对,孤对电子对数为2对,价层电子对数为4对,分子的立体构型为V形,与水具有相同空间构型的一个分子可能是SO2或H2S,一个离子可能为NO![]() 或NH
或NH![]() ;CH3CHO分子中含有碳氢单键,碳碳单键,碳氧双键,单键都是σ键,双键中,一个是σ键,一个是π键,CH3CHO中所含的共价键类型有σ键和π键,甲基上碳原子的杂化方式是sp3杂化,醛基上的碳原子采用sp2杂化,CH3CHO中碳原子的杂化方式为sp2和sp3杂化;
;CH3CHO分子中含有碳氢单键,碳碳单键,碳氧双键,单键都是σ键,双键中,一个是σ键,一个是π键,CH3CHO中所含的共价键类型有σ键和π键,甲基上碳原子的杂化方式是sp3杂化,醛基上的碳原子采用sp2杂化,CH3CHO中碳原子的杂化方式为sp2和sp3杂化;
(3) La位于棱上和体心,个数为8×![]() +2=4;Cu位于上下顶点和体心,个数为8×
+2=4;Cu位于上下顶点和体心,个数为8×![]() +1=2,O原子位于第一层和第三层的棱上和第二层的面上和体心,个数为8×
+1=2,O原子位于第一层和第三层的棱上和第二层的面上和体心,个数为8×![]() +4×
+4×![]() +2=8,,该化合物的化学式为La2CuO4;图中可以看出与Cu2+紧邻的O2-的个数为6;将阿伏加德罗常数为NA,N=2,M=406g/mol,V=a2bpm3代入ρ=
+2=8,,该化合物的化学式为La2CuO4;图中可以看出与Cu2+紧邻的O2-的个数为6;将阿伏加德罗常数为NA,N=2,M=406g/mol,V=a2bpm3代入ρ=![]() ,则晶胞密度ρ=
,则晶胞密度ρ=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________,与CN-互为等电子体的分子是________,离子是________。
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图。关于它的说法中正确的是

A.该有机物能发生银镜反应
B.分子中有 4 个碳碳双键
C.既能被还原,又能被氧化
D.1mol 该物质最多跟 6mol 氢气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,下列说法不正确的是( )
A.常温常压下,30 g乙烷气体中所含有的共价键数目为6NA
B.含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为l.5NA
D.在电解精炼铜的过程中,当阴极析出32g铜单质时,电子转移数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取一定量淀粉进行水解实验,其实验步骤如下所示:

请回答下列问题:
① 所加入的试剂分别是
A_______,B________,C________;
② 加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A. 洗气瓶中产生的沉淀是碳酸钡B. 洗气瓶中产生的沉淀是亚硫酸钡
C. 在Z导管出来的气体中没有二氧化碳D. 在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可用作脱氯剂,已知25.0 mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2![]() 转化成( )
转化成( )
A.S2-B.SC.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
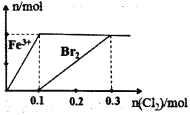
A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com