
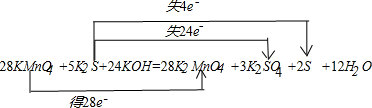
| 6.4g |
| 32g/mol |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
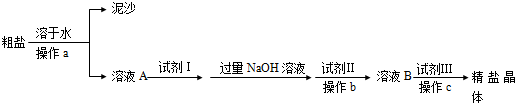
科目:高中化学 来源: 题型:
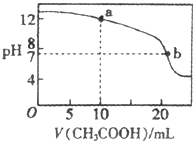 常温下有下列四种溶液:
常温下有下列四种溶液:| ① | ② | ③ | ④ | ||
| 溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1mol?L-1的醋酸 | 0.1mol?L-1的NaOH | |
查看答案和解析>>
科目:高中化学 来源: 题型:
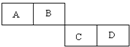 A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| 试剂A |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(3) |
| B、(1)(4) |
| C、(2)(3) |
| D、(2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸中加入过量铁粉:Fe+NO3-+4 H+═Fe3++NO↑+2 H2O |
| B、向碘化亚铁溶液中通少量氯气:Cl2+2Fe2+═2Fe3++2Cl- |
| C、工业刻蚀印刷电路板:2 Fe3++Cu═2 Fe2++Cu2+ |
| D、氢氧化铁溶于氢碘酸:Fe(OH)3+3 H+═Fe3++3 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com