
【题目】下列说法正确的是( )
A. 对于N2(g) + 3H2(g) ![]() 2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
B. 对某一可逆反应,升高温度则化学平衡常数一定变大
C. 平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D. 改变条件,使反应物的平衡转化率都增大,该可逆反应的平衡常数一定增大
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
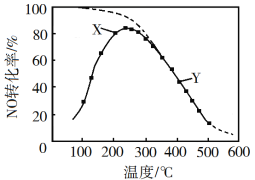
A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 是中学化学中的常见气体,也是大气污染物的主要组成成分。回答下列问题:
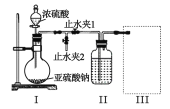
⑴甲组同学利用下列装置制备并收集干燥的 SO2:
装置Ⅰ中盛装亚硫酸钠的仪器名称是_______,装置 II 的作用是对 SO2 气体进行干燥,该装置中所盛 试剂名称为_________,装置 III 为集气装置,应选取填入 III 中的集气装置为___________(选填字母代号)。
⑵乙组同学利用下列装置制备 SO2 并探究其性质:
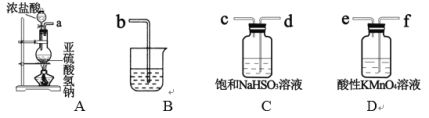
①该组同学的实验装置中,依次连接的合理顺序为a→_________。装置C中饱和NaHSO3溶液的作用是________。
②能证明SO2具有还原性的现象是___________,该反应的离子方程式为_________________。
③装置B的作用吸收SO2尾气,该装置中盛装的试剂是_______________。
⑶设计实验证明H2SO3为弱电解质:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积不变容器中,N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,下列说法不正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,下列说法不正确的是( )
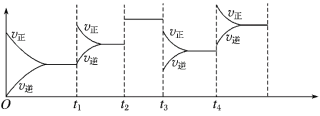
A. t1时刻增大c(N2)或c(H2)B. t2时刻加入催化剂
C. t3时刻降低温度D. t4时刻往容器中充入He,以增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含CN-电镀废水的一种方法如图(CN-和CNO-中N的化合价均为-3价)

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)装置甲玻璃仪器名称为________________;装置乙中反应的离子方程式为________________。
(2)装置丙中的试剂是________________,装置丁的作用是________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408g。则CN-被处理的百分率为________________。
(4)你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会________________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________(填方案编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某港口化学品堆场发生火灾,消防队在未被告知着火可燃物类别的情况下,用水灭火时,发生了剧烈爆炸。事后有关部门初步认定危化品部分清单:钾、钠、氯酸钾、烧碱、氯化铵。试回答:
⑴请你分析用水灭火时,随后发生了剧烈爆炸的原因是_____________________________。
⑵请写出氯化铵中NH4+的检验方法____________________________(简要说明操作步骤)。
⑶钠燃烧产物中可作为消防员呼吸面具供氧剂的是_________________(写化学式)。
⑷硝酸钾受热分解产生KNO2和O2,写出该反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
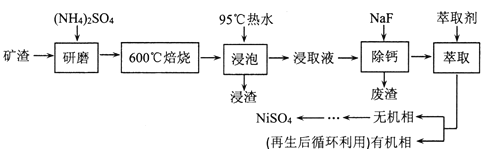
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。

①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原的化合反应是
A.Na2CO3+CaCl2===CaCO3↓+2NaClB.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3![]() Na2CO3+CO2↑+H2OD.Na2O2+SO2===Na2SO4
Na2CO3+CO2↑+H2OD.Na2O2+SO2===Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com