
| A. | 使用催化剂是为了加快反应速率和提高SO2的转化率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度不变 | |
| C. | 达到平衡时,v(SO2)正=v(O2)逆 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
分析 根据该反应是前后气体体积减小的放热反应,利用外界条件对化学平衡的影响因素分析,
A、催化剂改变反应速率不改变化学平衡;
B、浓度不变是平衡的标志;
C、速率之比等于化学方程式计量数之比分析;
D、两种反应物,增大一种物质浓度会提高另一种物质的转化率.
解答 解:A、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,SO2的转化率不变,故A错误;
B、物质浓度不变是平衡的标志,达到平衡时,SO2的浓度与SO3的浓度不变,故B正确;
C、速率之比等于化学方程式计量数之比,达到平衡时v(SO2)正=2v(O2)逆 ,才能说明氧气正逆反应速率相同,反应达到平衡状态,故C错误;
D、达到平衡时,增大氧气浓度平衡正向移动,二氧化硫转化率增大,故D正确;
故选AC.
点评 本题考查了影响化学平衡移动的因素,难度中等,注意影响化学反应速率和化学平衡的影响因素分析判断.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
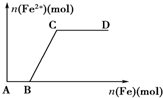 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )| A. | AB段铁元素以①形式存在 | B. | CD段铁元素以③形式存在 | ||
| C. | BC段铁元素以④形式存在 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SO4溶液中加入过量BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42- | |
| B. | Ksp小的物质的溶解能力一定比Ksp大的物质的小 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 洗涤沉淀时,洗涤次数越多越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应的活化能比逆反应的活化能大146 kJ•mol-1 | |
| B. | 正反应的活化能一定小于146 kJ•mol-1 | |
| C. | 逆反应的活化能一定大于146 kJ•mol-1 | |
| D. | 逆反应的活化能一定大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题:
羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com