
 氢氧化钠溶液 | 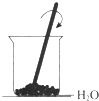 Ba(OH)2+H2O+NH4Cl | 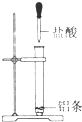 | 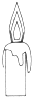 蜡烛燃烧 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
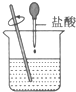
解答 解:A、酸碱中和为放热反应,故盐酸和氢氧化钠的反应为放热反应,故A错误;
B、铵盐和强碱的反应为吸热反应,故Ba(OH)2•8H2O和NH4Cl的反应吸热,故B正确;
C、金属和盐酸的反应为放热反应,故铝条和盐酸的反应为放热反应,故C错误;
D、物质的燃烧一定为放热反应,故蜡烛的燃烧放热,故D错误.
故选B.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:解答题
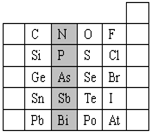 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
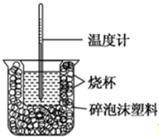
| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
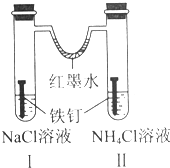
| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到7.8g沉淀 | |
| C. | 最终得到的溶液中只含NaCl溶质 | |
| D. | 最终得到的溶液中c(Na+)=1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com