
| A. | C15H22O5 | B. | C15H20O5 | C. | C15H18O5 | D. | C15H24O5 |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
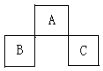 A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )| A. | Be、Na、Al | B. | O、P、Cl | C. | P、O、Cl | D. | C、Al、P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 等质量的烃CxHy完全燃烧耗氧量的多少取决于y/x的值的大小,y/x的值越大,耗氧量越多 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y<4;否则y>4 | |
| D. | 质量相同的两种有机物完全且充分燃烧产生等量的二氧化碳,则这两种有机物中碳元素的质量分数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油作护肤保湿剂是因为甘油有还原性 | |
| B. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验现象 | 相关解释 | |
| A | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | NO2有助燃性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
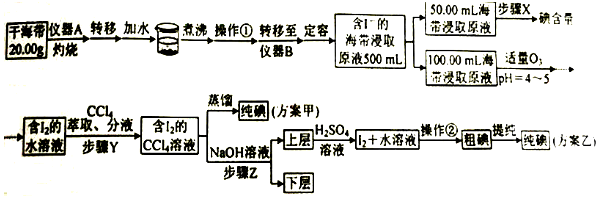
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com