
| A、增大压强 |
| B、降低温度 |
| C、加入催化剂 |
| D、减小反应物浓度 |
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自来水中通入少量Cl2进行消毒杀菌 |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢 |
| D、用小苏打发酵面团制作馒头 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 | ||||
B、反应A+B
| ||||
| C、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| D、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
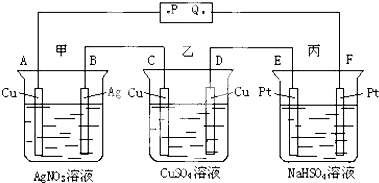
| A、P是电源的正极 |
| B、F极上发生的反应为:4OH--4e-=2H2O+O2↑ |
| C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 |
| D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com