
| A. | 5mL | B. | 20mL | C. | >20mL | D. | <20mL |
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Na+、MnO4-、CO32-、Cl- | |
| B. | 能使紫色石蕊试剂变红的溶液中:OH-、K+、Ba2+、Na+ | |
| C. | 透明的酸性溶液中:Fe3+、Mg2+、Cl-、NO3- | |
| D. | pH=1的溶液中:NH4+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | HCO3- | C. | Na+ | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
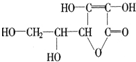
| A. | 是一个环状的酯类化合物 | B. | 易起加成及氧化反应 | ||
| C. | 可以溶解于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.
(1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
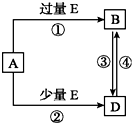
| A. | ②③④⑤ | B. | ①③④⑤⑥ | C. | ①②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com