
| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
分析 A.铜与稀硝酸反应生成一氧化氮;
B.石灰乳中氢氧化钙应保留化学式;
C.硫酸氢铵少量,反应生成硫酸钡、水和一水合氨;
D.盐酸与偏铝酸钠反应,首先生成氢氧化铝沉淀,盐酸过量氢氧化铝转化为氯化铝;
解答 解:A.铜溶于0.5 mol﹒L-1的硝酸中,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故A错误;
B.工业上将Cl2通入石灰乳中制漂白粉,离子方程式:2Cl2+2Ca(OH)2=2Ca2++2Cl-+2ClO-+2H2O,故B错误;
C.向Ba(OH)2溶液中加入少量的NH4HSO4溶液,离子方程式:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O,故C错误;
D.1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合,离子方程式:2AlO2-+5H+═Al3++Al(OH)3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,选项CD为易错选项.


科目:高中化学 来源: 题型:解答题
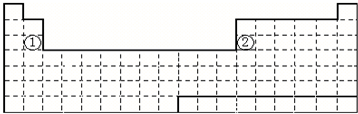
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
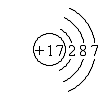
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(2 p) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 | |
| C. | 某元素基态原子的电子排布图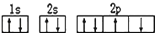 | |
| D. | Ca2+离子基态电子排布式为1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1molC3H8所含有的共价键数目为1.1 NA | |
| B. | 1mol苯分子中,含有碳碳双键的数目为3 NA | |
| C. | 常温常压下,15g甲基(-CH3)所含的电子数为10NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C2H4O2的有机化合物性质相同 | |
| B. | 由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=(E1-E2)kJ•mol-1 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | Na2O2与CO2反应产生1 mol O2理论上转移的电子数约为26.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.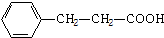 .
. 单体.
单体.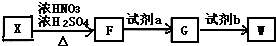
 ,试剂a为酸性KMnO4 溶液.
,试剂a为酸性KMnO4 溶液. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有二氧化锰的锥形瓶中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:MnO2>Cl2 |
| B | 分别向水和乙醇中投入等质量、等大小的金属钠 | 水中产生气泡较快 | 羟基中氢的活泼性:H2O>乙醇 |
| C | 向滴有KSCN试剂的Fe(NO3)2的溶液中加入盐酸 | 溶液变红 | Fe2+被盐酸氧化为Fe3+ |
| D | 向饱和石灰水中加入Na2O2 | 有白色沉淀析出 | Na2O2与Ca(OH)2反应生成白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com