
 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1 2H2O(g) ΔH="-483.6" kJ·mol-1
2H2O(g) ΔH="-483.6" kJ·mol-1 CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 | C.-352.3 kJ·mol-1 | D.+262.6 kJ·mol-1 |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:填空题
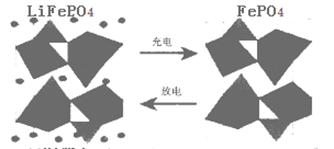
 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能/ kJ·mol-1 | 436 | 243 | 431 |
 H2(g)+
H2(g)+ Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1 H2(g)+
H2(g)+ Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1 Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5| A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 |
| B.ΔH=ΔH1-ΔH2-ΔH3-ΔH4-ΔH5 |
| C.ΔH=ΔH1-ΔH2+ΔH3-ΔH4+ΔH5 |
| D.ΔH=ΔH2+ΔH3+ΔH4+ΔH5-ΔH1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
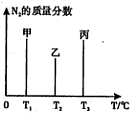
 2NH3(g) △H=—92.4kJ/mol,
2NH3(g) △H=—92.4kJ/mol,| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 (NH2)2CO +H2O
(NH2)2CO +H2O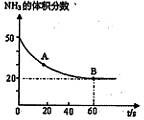
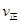 (CO2) B点的逆反应速率
(CO2) B点的逆反应速率 (CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ;
(CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ; 2NO(g) △H =+180kJ/mol
2NO(g) △H =+180kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。| 方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
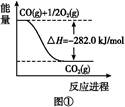
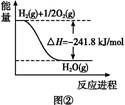

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.△H=△H 1+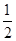 △H 2+ △H 2+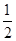 △H 3 △H 3 | B.△H=△H 1+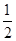 △H 2- △H 2-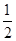 △H 3 △H 3 |
| C.△H=△H 1+2△H 2+2△H 3 | D.△H=2△H 1+△H 2+△H 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2| A.①②③ | B.②④ | C.②③④ | D.③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com