
 HCO3-+OH-
HCO3-+OH-  Si+4HCl(2分)
Si+4HCl(2分) HCO3-+OH-。
HCO3-+OH-。 Si+4HCl。
Si+4HCl。

科目:高中化学 来源:不详 题型:问答题
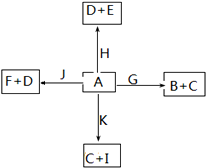
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.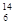 C和 C和 N的质量数相同,中子数不同 N的质量数相同,中子数不同 |
| B.IA族元素的金属性一定比IIA族元素的金属性强 |
| C.同周期主族元素的原子形成的简单离子电子层结构相同 |
| D.HCl、H2S、PH3的热稳定性由弱到强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y的单质能将X从NaX的溶液中置换出来 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X与H2化合放出的能量比Y与H2化合放出的能量少 |
| D.X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 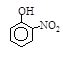 | 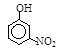 | 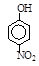 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.基态原子含有未成对电子最多的第二周期元素 |
| B.某激发态为1s22s12p3的原子 |
| C.基态原子最外层电子排布为2s22p6的元素 |
| D.基态原子最外层电子排布为3s23p5的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.48Ti和50Ti的质子数相同,互称同位素 |
| B.48Ti和50Ti的质量数不同,属于两种元素 |
| C.48Ti和50Ti的质子数相同,是同一种核素 |
| D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第3周期第Ⅷ族 | B.第3周期第ⅤB族 |
| C.第4周期第Ⅷ族 | D.第4周期第ⅤB族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com