
【题目】下列溶液中,溶质的物质的量浓度为1molL﹣1的是( )
A.将40 g NaOH溶于1 L水所得的溶液
B.将22.4 L HCl溶于水配成1 L溶液
C.1 L含2 mol K+的K2SO4溶液
D.将0.5 molL﹣1的NaNO3溶液100 mL加热蒸发掉50 g 水后的溶液
【答案】C
【解析】A.40g氢氧化钠为1mol,体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A根;
B.氯化氢所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,体积一定,影响气体的物质的量的因素有温度、压强,22.4LHCl气体的物质的量不一定是1mol,故B不符合题意;
C.1 L含K+的物质的量为2 mol的K2SO4溶液中,c(K+)= ![]() =2mol/L,故c(K2SO4)=2mol/L×
=2mol/L,故c(K2SO4)=2mol/L× ![]() =1mol/L,故C符合题意;
=1mol/L,故C符合题意;
D.加热蒸发掉50g水后的溶液体积不是50mL,则溶液浓度不是1mol/L,故D不符合题意;
所以答案是:C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知Cl﹣、Br﹣、Fe2+、I﹣的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: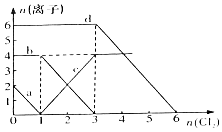
(1)a、c线分别代表溶液中、(填离子符号,下同)的变化情况.
(2)原溶液中Fe2+与Br﹣的物质的量为 .
(3)原混合溶液中FeI2的物质的量为 .
(4)当通入2mol Cl2时,溶液中离子反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g) ![]() 2C(g),根据下表中的数据判断下列图象错误的是( )
2C(g),根据下表中的数据判断下列图象错误的是( )
| p1(Mpa) | p2(Mpa) |
400℃ | 99.6 | 99.7 |
500℃ | 96.9 | 97.8 |
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)用量筒量取所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(填偏高、偏低、无影响).
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是
(4)将冷却后的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯次,洗涤液也要注入容量瓶中,并摇匀.如未冷却就转移,则所配溶液的浓度会(填偏高、偏低或无影响);若未洗涤烧杯,则所配溶液的浓度会(填偏高、偏低或无影响).
(5)加水至液面距刻度线下时,改用加水,使溶液的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
A.1.2 mol
B.1.5 mol
C.1.8 mol
D.2.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所选择的装置或仪器正确的是( )
A | B | C | D | |
实 | 用CCl4提取溴水中的Br2 | 分离Fe(OH)胶体中的FeCl3溶液 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 molL﹣1 KMnO4溶液 |
装置或仪器 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题
:
(1)该电池的正极反应式为 .
(2)已知在25℃、101kPa时,C2H6(g)的燃烧热为1559.8kJ/mol,请写出
C2H6(g)燃烧热的热化学方程式为
(3)若将上述装置中的H2改为通入CH4(g)请写出该燃料电池的负极反应式为
.
(4)假设使用的燃料为CH4 , 如用这种电池电镀铜,待镀金属的质量增加12.8g,则至少消耗标准状况下CH4的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com