
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
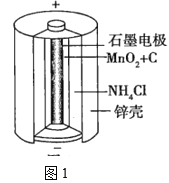
(1)锌锰干电池是应用最普遍的电池之一,图1为锌锰干电池的构造示意图,锌锰干电池的负极材料是___(填物质名称),负极发生的电极反应为___。若反应消耗32.5g负极材料,则电池中转移电子的数目为___。
(2)目前常用的镍-镉(Ni—Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
①该电池可以在酸性条件下进行充、放电。
②该电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能。
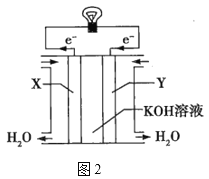
(3)图2为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的__(填“正”或“负”)极,X极的电极反应式为___。
【答案】锌 Zn-2e-=Zn2+ 6.02×1023 ②④ 负 H2-2e-+2OH-=2H2O
【解析】
锌锰干电池是应用最普遍的电池之一,锌为负极,发生氧化反应;镍-镉(Ni—Cd)可充电电池,放电为原电池,充电为电解池,氢氧燃料电池属于新型电池,氢气做负极,发生氧化反应,氧气在正极发生还原反应,在分析和书写极反应时,要注意电解质溶液的性质。
(1)负极发生氧化反应,锌失去电子被氧化,所以负极材料为锌,电极反应式为Zn-2e-=Zn2+,32.5g锌的物质的量为0.5mol,1mol锌参与反应失去2mol电子,所以32.5g锌参与反应时转移电子的物质的量为1mol,数目为6.021023。
答案为:锌;Zn-2e-=Zn2+;6.021023。
(2)①Ni(OH)2与Cd(OH)2可以与酸反应,则该电池不能在酸性条件下进行充、放电,①错误;
②电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2,②正确;
③电池放电时,Cd为负极,发生氧化反应生成Cd(OH)2,Cd极的质量增加,③错误;
④该电池放电时为原电池,化学能转化为电能,④正确。
答案选②④。
(3)电解质溶液为KOH溶液,X电极上失去电子,为负极,氢气在负极失电子被氧化,电极反应式为:H2+2OH--2e-=2H2O。
答案为:H2+2OH--2e-=2H2O。


科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
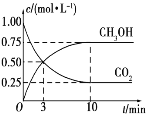
A.升高温度能使![]() 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
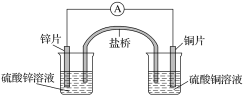
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )
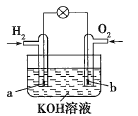
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有利于可持续发展的生态环境是全国文明城市评选的测评项目之一。
(1)已知反应 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=![]() 的关系如图 1 所示。
的关系如图 1 所示。

①达到平衡后,仅升高温度,k正增大的倍数________填“>”“<”或“=”)k逆增大的倍数。
②下列说法正确的是_______。
A 投料比:m1<m2<m3
B 汽车排气管中的催化剂可提高 NO 的平衡转化率
C 当投料比 m=2 时,NO 转化率比 CO 转化率小
D 当体系中 CO2 和 CO 物质的量浓度之比保持不变时,反应达到平衡状态
③若在 1L 的密闭容器中充入 1 molCO 和 1 mol NO,在一定温度下达到平衡时,CO 的转化率为 40%, 则 k 正︰k 逆=_______(填写分数即可,不用化简)
(2)在 2L 密闭容器中充入 2mol CO 和 1mol NO2,发生反应 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
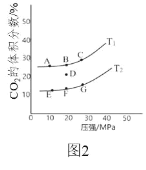
①该反应达到平衡后,为在提高反应速率同时提高 NO 的转化率,可采 取的措施有______(填字母序号)
a 增加 CO 的浓度 b 缩小容器的体积 c 改用高效催化剂 d 升高温度
②若在 D 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中 A G 点中的______点。
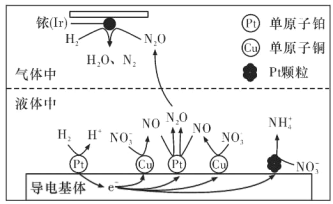
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 H2 可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如下图所示。若导电基体上的 Pt 颗粒增多,造成的后果是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D1、D2均为有机化合物,请根据图示回答问题.

(1)直链有机化合物A的结构简式是______________;
(2)①的反应类型是____________________;.
(3)②的反应类型是__________________;
(4)③的反应类型是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图的能量图,下列说法正确的是( )

A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB(g)的总能量大于1mol A2(g)和1mol B2(g)的能量之和
C. 1mol A2(g)和1 mol B2(g)的能量之和为a kJmol﹣1
D. 2AB(g)═A2(g)+B2(g)△H=( a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤、天然气和生物质为原料制取有机化合物日益受到重视。E是两种含有碳碳双键的酯的混合物。相关物质的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1) A→B的反应类型________,C中含氧官能团的名称________。
(2) C与D反应得到E的化学方程式________。
(3) 检验B中官能团的实验方法________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大。
的原子序数依次增大。![]() 与
与![]() 同周期且相邻的非金属元素,
同周期且相邻的非金属元素,![]() 的基态原子的s电子数与p电子数相等,
的基态原子的s电子数与p电子数相等,![]() 是地壳中含量最多的金属元素,
是地壳中含量最多的金属元素,![]() 的原子核外价电子排布式为
的原子核外价电子排布式为![]() ,
,![]() 的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
A.简单气态氢化物的稳定性:![]()
B.简单离子的半径:![]()
C.![]() 的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由![]() 、
、![]() 、
、![]() 三种元素形成的某种化合物可用于检查司机是否酒后驾车
三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com