
| A、在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| B、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3?H2O+H2O |
| C、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |


科目:高中化学 来源: 题型:
| A、使压强增大 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使压强增大 |
| D、压强不变充入N2使体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L氢气中,一定含有氢原子2NA |
| B、在常温常压下,28gCO和N2的混合气体中含有的分子数为NA |
| C、常温下,pH=1的盐酸溶液,含有H+数目是0.1NA |
| D、标准状态下,2.7g铝和足量的浓硝酸反应,转移的电子数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
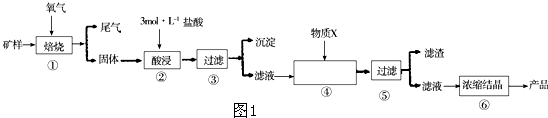
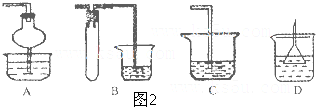
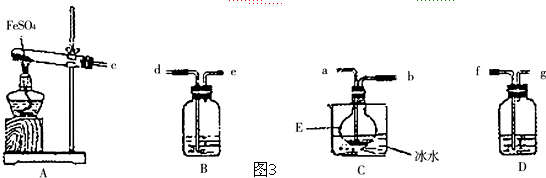
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当容器内混合气体的密度不再发生变化时,反应即达到平衡状态 |
| B、达平衡后若升高温度,该反应的平衡常数将增大 |
| C、平衡时反应物B的转化率为15.0% |
| D、达平衡后,如果此时移走2 molA和1molB,在相同温度下再达平衡时C的浓度<0.3mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com