
(1)写出表示含有8个质子,10个中子的原子的化学符号________;
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________;
(3)比较下列大小(填“>”或“<”)
A.原子半径:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。
回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号)。
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 。
(4)单质D在充足的单质E中燃烧,反应的化学方程式为 ;
(5)单质E与水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。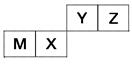
请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是________(写化学式),该氢化物的电子式为________。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是________,列举一个化学方程式证明________________________。
(3)元素Z与元素M组成的化合物中所含化学键类型为________,元素Z与元素X组成的化合物中所含化学键类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数
与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知86Rn(氡)基态原子的电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6,88Ra基态原子的电子排布式可简化为[Rn]7s2。114号元素是化学家和物理学家很感兴趣的尚未发现的元素。
(1)用简化的形式写出114号元素基态原子的电子排布式: ______________
________________________________________________________________。
(2)根据原子核外电子排布的特征,判断114号元素在周期表中的第________周期________族。
(3)根据114号元素在周期表中的位置判断,它最不应具有的性质是________。
第一电离能大于88Ra
②鲍林电负性大于3.0
③最高化合价为+4价,也可有+2价
④最高价氧化物的对应水化物显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | |||||
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | ⑨ |
| 4 | ⑩ | | | | | | | |
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是________,丙分子的电子式为________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为___________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g)  2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com