
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示),已知Ca2+、O2—、Ti4+分别位于立方体的体心、面心和顶点,则每个Ti4+和12个O2—相紧邻
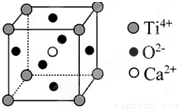
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:选择题
同温下,向甲(保持恒容)乙(保持恒压)两个容器中分别加入物质的量均为1mol的A与B发生可逆反应A(g)+B(g) C(g),起始时两容器的体积相等,达到平衡状态后,下列说法正确的是( )
C(g),起始时两容器的体积相等,达到平衡状态后,下列说法正确的是( )
A.容器甲中分子总数多 B.容器甲中C的浓度大
C.容器甲中反应速率快 D.容器甲中转化率大
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+=SO2↑+H2O
B.漂白粉溶液中通入足量二氧化硫气体:ClO﹣+SO2+H2O═HClO+HSO3-
C.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3﹣+Ba2++OH﹣═BaCO3↓+H2O
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH )2↓+O2↑
)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
下列关于“中和反应反应热的测定”实验描述,正确的是
A.实验过程中,用环形铜棒搅拌,使溶液充分混合
B.为了操作方便,可将0.11gNaOH固体迅速投入50mL0.50mol/L的盐酸中进行反应
C.用量筒量取50.0mL盐酸时,俯视刻度导导致所取盐酸体积偏大
D.为了反应充分进行,使用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
下列物质中,属于强电解质的是
A.CO2 B.NaOH溶液 C.NH3.H2O D.HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列关于晶体的叙述中,不正确的是
A、金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子
B、在氯化钠的晶体中,每个Na+或Cl-的周围都紧邻6个Cl-或Na+
C、在氯化铯晶体中,每个Cs+周围都紧邻8个Cl—,每个Cl—周围也紧邻8个Cs+
D、在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O H2SO3+OH- ①
H2SO3+OH- ①
HSO3- H++SO32- ②
H++SO32- ②
向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B.加入少量NaOH溶液,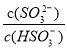 、
、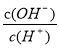 的值均增大
的值均增大
C.加入少量Na2SO3 固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+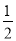 c(SO32-)
c(SO32-)
D.加入氨水至中性,则 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素。氮及其化合物在在工农业生产、生活中有着重要作用。
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
T/K | 298 | 398 | 498 |
平衡常数K | 4.1 x 106 | K1 | K2 |
如果合成氨反应的方程式写为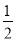 N2(g)+
N2(g)+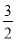 H2(g)
H2(g) NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
(2)下列能说明合成氨反应已达到平衡状态的是___________(填序号)。(反应是在固定体积的密闭容器中进行的)
A.容器内温度保持不变
B.v正(N2)=3v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
(3)合成氨工业中,按照勒夏特列原理,工业生产中应采用的条件为高压、低温,但事实上反应中并未采用较低的温度,原因是_____________________。
(4)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业迅速发展,需要使用大量的硝酸。
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应的化学方程:________________________。
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。反应中的还原产物是_________________, 0.8mol Cu被硝酸完全溶解后,如果得到NO和NO2物质的量相同,那么标准状况下的气体体积为_________________L。(标况下NO和NO2视为气体)
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:填空题
利用电化学原理可以解决很多问题。
(1)精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中常用的银电量计结构如图所示。

①电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是_____________;
②实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会____________(填“偏高"“偏低”或“无影响”);
③若要测定电解精炼铜时通过的电量,可将该银电量计中的银棒与待测电解池的________电极相连。
(2)如图所示,将铁棒和石墨棒插人盛有饱和NaCl溶液的U型管中。
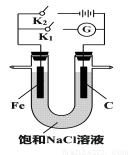
①K1闭合,铁棒上发生的反应为______________;
②K2闭合,铁棒不会被腐蚀,属于_________保护法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com