
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
科目:高中化学 来源: 题型:选择题
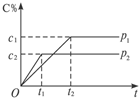 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )| A. | p1>p2 | B. | 反应吸热 | C. | m+n>p+q | D. | m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-) | |
| D. | 1.5 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重4.4 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 NaCl | B. | NaHCO3 H2SO4 | ||
| C. | AlCl3 氨水 | D. | NaAlO2 HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 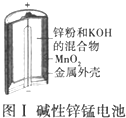 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 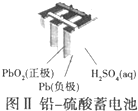 图Ⅱ所示电池工作时,负极质量减轻 | |
| C. | 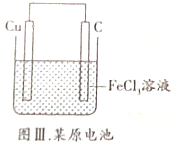 图Ⅲ所示装置工作过程中,Cu作正极 | |
| D. | 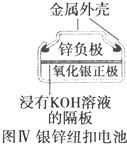 图Ⅳ所示电池为一次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| B. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| C. | 二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 | |
| D. | 铜盐能使蛋白质变性,游泳场馆常用硫酸铜作池水消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com