
| A、N2(g)+3H2(g)?2NH3(g)△H<0 |
| B、H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| D、2SO3(g)?2SO2(g)+O2(g)△H>0 |


科目:高中化学 来源: 题型:
| A、先加氯水,再滴加KSCN溶液后显红色 |
| B、先滴加KSCN溶液,不显红色,再滴加氯水后显血红色 |
| C、滴加NaOH溶液,产生红褐色沉淀 |
| D、只需要滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+是该反应的催化剂 |
| B、反应速率与c(H2O2)无关 |
| C、H2O是该反应的催化剂 |
| D、v(IO3-)=v(HSO3-)=v(HSO4-)=v(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种物质反应,不管怎样书写化学方程式,平衡常数不变 | ||
B、某温度下,2L密闭容器中加入4 mol A和2 molB发生反应:3A(g)+2B(g)?4C(s)+2D( g).平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
| ||
| C、温度一定时,当溶液中( Ag+)?c( Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液 | ||
| D、难溶电解质AB2饱和溶液中,c(A2+)=xmol?L-1,c(B-)=y mo L?-1,则Ksp值为4xy2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Mn | Fe | |
| 电离能 kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
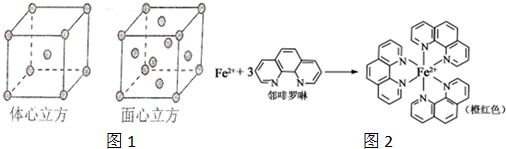
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染 |
| B、将煤气化或液化,获得清洁燃料 |
| C、推广使用无磷洗衣粉和无氟冰箱 |
| D、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应 Na+H2O=Na++OH-+H2↑ |
| B、NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com