
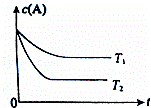
反应A(g)⇌B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如右图所示.回答下列问题:
(1)上述反应的温度T1小于 T2,平衡常数K(T1) K(T2).(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 .
②反应的平衡常数K= .
③反应在0~5min区间的平均反应速率v(A)= .
考点: 物质的量或浓度随时间的变化曲线;化学平衡的计算.
专题: 化学平衡专题.
分析: (1)温度越高达平衡所需的时间越短,然后结合图象分析反应的热效应,从而得出K的变化情况;
(2)根据三行式,结合平衡常数和反应速率的公式来求解.
解答: 解:(1)由图可知T2先达平衡状态,所以T1小于T2,而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,故答案为:小于;小于;
(2)A(g)⇌B(g)+C(g)
起始浓度:0.050 0 0
变化浓度:0.035 0.035 0.035
平衡浓度:0.015 0.035 0.035
①平衡时体系总的物质的量为=(0.015+0.035+0.035)×1=0.085mol;
②K=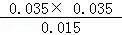 =0.082mol/L;
=0.082mol/L;
③反应在0~5min区间的平均反应速率v(A)=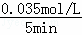 =0.007mol/(L•min);
=0.007mol/(L•min);
故答案为:0.085mol;0.082mol/L;0.007mol/(L•min).
点评: 本题考查了化学反应能量变化,化学平衡影响因素的分析判断,图象分析与化学平衡的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:
一定温度下,在一定容积的密闭容器中发生如下可逆反应:
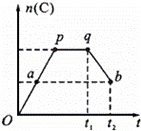
2A(g)+B(g)⇌2C(g),在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度).试回答下列问题:
(1)a点时,反应的v(正) v(逆)(填“>”、“<”或“=”);
(2)此反应的逆反应为 热反应(填“放”或“吸”);
(3)a、b两点的正反应速率:v(a) v(b)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是()
A. 若M(甲)>M(乙),则气体体积:甲<乙
B. 若M(甲)<M(乙),则气体压强:甲>乙
C. 若M(甲)>M(乙),则气体的摩尔体积:甲>乙
D. 若M(甲)<M(乙),则分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是()
A. 未通电前上述镀锌装置可构成原电池,电镀过程是该电池的充电过程
B. 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C. 电镀时保持电流恒定,升高温度不改变电解反应速率
D. 镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)⇌Si(g)+4HCl(g);△H=+Q kJ•mol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述 正确的是()
正确的是()
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C. 反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(L•min)
D. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1mol•L﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
模型法是化学中把微观问题宏观化的最常见方法,对于2HBr(g)⇌H2(g)+Br2(g)反应.下列四个图中可以表示该反应在一定条件下为可逆反应的是()
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:
2SO2(g)+O2(g)⇌2SO3(g)+197kJ
实验测得有关数据如表:
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化/KJ
SO2 O2 SO3
甲 2 1 0 Q1
乙 1.8 0.9 0.2 Q2
丙 0 0 2 Q3
下列判断中正确的是()
A. 197>Q2>Q1
B. 若升高温度,反应的热效应不变
C. Q3=﹣197kJ
D. 生成1mol SO3(l)时放出的热量大于98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氧化物的叙述正确的是( )
|
| A. | 非金属氧化物一定是酸性氧化物 |
|
| B. | 酸性氧化物都可以与水反应可生成酸 |
|
| C. | 金属氧化物不一定是碱性氧化物 |
|
| D. | 不能跟酸反应的氧化物一定能和碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol﹣1、1411.0kJ•mol﹣1和1366.8kJ•mol﹣1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为()
A. ﹣44.2 kJ•mol﹣1 B. +44.2 kJ•mol﹣1
C. ﹣330 kJ•mol﹣1 D. +330 kJ•mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com