
| A. | 1:3 | B. | 1:7 | C. | 1:1 | D. | 5:3 |
分析 发生反应:C2H4+3O2=2CO2+2H2O,120℃时水为气体,反应前后气体的物质的量不变,平均相对分子质量不变,由反应后的相对氢气的密度计算原混合气体中乙烯和氧气的平均相对分子质量,利用十字交叉法计算原混合气体中乙烯和氧气的体积比.
解答 解:120℃时燃烧生成的水为气态,氧气过量发生反应:C2H4+3O2=2CO2+2H2O,由方程式可知反应前后气体的物质的量不变,故平均相对分子质量不变,反应后气体密度为相同条件下H2密度的14.75倍,故原混合气体中乙烯和氧气的平均相对分子质量为14.75×2=29.5,根据十字交叉法: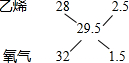 ,故原混合气体中乙烯和氧气的体积比为2.5:1.5=5:3,
,故原混合气体中乙烯和氧气的体积比为2.5:1.5=5:3,
故选D.
点评 本题考查混合物的计算,根据方程式的化学计量数判断反应前后混合气体的平均相对分子质量不变是关键,本题利用十字交叉法解答,注意理解.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①→④→③→② | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→②→③→④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y |
| Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com