


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250 mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了的弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
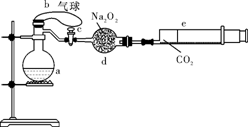
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的现象是 。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。
①若用加入化学试剂法,下列试剂中可以选用的是 。
A.蒸馏水 B.无水醋酸钠
C.石墨 D.少量硝酸银溶液
②将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是4NO2+O2+2H2O===4HNO3 或4NO+3O2+2H2O===4HNO3 ,此时气球是全在烧瓶外还是一部分进入烧瓶 。
③打开弹簧夹,将二氧化碳反推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL。
④将上述全过程用一个总的化学方程式表示: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250 mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了的弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的现象是 。(2分)
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。
①若用加入化学试剂法,下列试剂中可以选用的是 。
A.蒸馏水 B.无水醋酸钠
C.石墨 D.少量硝酸银溶液
②将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是4NO2+O2+2H2O===4HNO3 或4NO+3O2+2H2O===4HNO3 ,此时气球是全在烧瓶外还是一部分进入烧瓶 。
③打开弹簧夹,将二氧化碳反推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL。
④将上述全过程用一个总的化学方程式表示: 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省温州市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
实验室制备肉桂酸的化学方程式为:

副反应: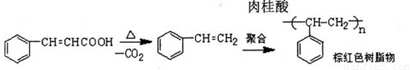
药品物理常数
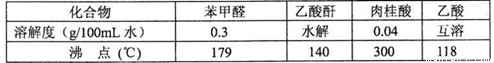
主要实验装置和步骤如下:
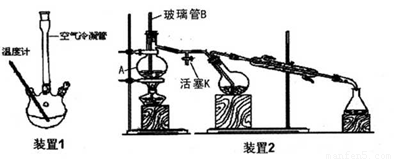
(I) 合成:
向装置1的三颈烧瓶中先后加入3g新熔融并研细的无水醋酸钠、3mL新蒸馏过的苯甲醛和 5.5mL乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐 渐加深,并伴有棕红色树脂物出现。
(II)分离与提纯:
①向反应液中加30mL沸水,加固体碳酸钠至反应混合物呈弱碱性。
②按装置2进行水蒸气蒸馏,在冷凝管中出现有机物和水的混合物,直到馏出液无油珠。
③剩余反应液体中加入少许活性炭,加热煮沸,趁热过滤,得无色透明液体。
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、重结晶,得肉桂酸无色晶体。 回答下列问题:
(1)合成过程中要求无水操作,理由是______。将含结晶水的醋酸钠加热制无水醋酸钠,观察到盐由固体→液体→固体→液体。第一次变成液体的原因是_____。
(2)合成过程的加热回流,要控制皮应呈微沸状态,如果剧烈沸腾,可能导致()
A. 使肉桂酸蒸出影响产率
B. 使乙酸酐蒸出影响产率
C. 肉桂酸脱羧成苯乙烯,进而生成苯乙烯低聚物,甚至生成树脂状物
D. 反应变缓慢
(3)仪器A的名称_____:玻璃管B的作用_____。
(4)分离和提纯操作中,步骤①加Na2CO3目的是_____。
(5)水蒸气蒸馏就是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物中,使该有机物在 ,低于1000C的温度下,与水共沸而随着水蒸气一起蒸馏出来。步骤②的目的____,蒸馏结束后先____,再____,以防倒吸。
(6)步骤③加活性炭目的是____:若趁热过滤在抽滤装置中进行,下列操作错误的是()
A.布氏漏斗和滤纸要事先用沸水预热
B.各步操作的动作一定要快
C.为防止滤纸破损,混和液必须用玻璃棒引流至布氏漏斗
D.吸滤瓶内的溶液可直接从支管口倒出
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖南省高三第七次月考化学试卷 题型:实验题
a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250 mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了的弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
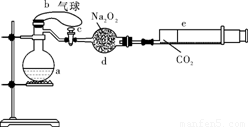
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的现象是 。(2分)
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。
①若用加入化学试剂法,下列试剂中可以选用的是 。
A.蒸馏水 B.无水醋酸钠
C.石墨 D.少量硝酸银溶液
②将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是4NO2+O2+2H2O===4HNO3 或4NO+3O2+2H2O===4HNO3 ,此时气球是全在烧瓶外还是一部分进入烧瓶 。
③打开弹簧夹,将二氧化碳反推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL。
④将上述全过程用一个总的化学方程式表示: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有人设计出一种在隔绝空气下让钠与水反应的方法,利用煤油来控制反
应速率。使学生能仔细观察到各种实验现象。该方法简便、安全、现象明显、
有趣味性,实验装置如图。
如图所示将6mm×50mm的玻璃管和长颈漏斗插入橡皮塞孔中,玻璃管外套上30mm的乳胶管,乳胶管上再接6mm×30mm金属尖嘴管,乳胶管上夹上弹簧夹。实验时,往100mL的大试管中先加入40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加满滴有酚酞的水。根据反应中观察到的现象,回答下列问题。
⑴金属钠变化的现象是
。
⑵大试管中溶液颜色的变化是 。
⑶装置中液面的变化分别是:大试管中 ;长颈漏斗中 。
⑷简述检验产生气体的方法: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com