
| A. | 原子序数:X>Y>Z>W | |
| B. | Y的气态氢化物的热稳定性比W的强 | |
| C. | 原子半径的大小顺序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分别与Y、Z形成的化合物中化学键类型相同 |
分析 X、Y、Z、W均为短周期元素,X是地壳中含量最高的元素,则X为O元素;Z2+与X2-具有相同的电子层结构,则Z为Mg;W原子的最外层电子数是其内层电子数的2倍,最外层电子数不超过8个,则其内层为K层,最外层电子数为4,则W为C元素;Y与W同主族,则Y为Si.
A.根据元素判断原子序数;
B.元素的非金属性越强,其气态氢化物的稳定性越强;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
D.O和Si、Mg形成的化合物分别为SiO2、MgO,前者属于原子晶体,后者属于离子晶体.
解答 解:X、Y、Z、W均为短周期元素,X是地壳中含量最高的元素,则X为O元素;Z2+与X2-具有相同的电子层结构,则Z为Mg;W原子的最外层电子数是其内层电子数的2倍,最外层电子数不超过8个,则其内层为K层,最外层电子数为4,则W为C元素;Y与W同主族,则Y为Si.
A.X为O、Y为Si、Z为Mg、W为C,故原子序数:Y>Z>X>W,故A错误;
B.同主族自上而下非金属性减弱,元素的非金属性越强,其气态氢化物的稳定性越强,所以W的气态简单氢化物的热稳定性比Y的强,故B错误;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径的大小顺序:r(Mg)>r(Si)>r(C)>r(O),故C正确;
D.O和Si、Mg形成的化合物分别为SiO2、MgO,前者属于原子晶体,含有共价键,后者属于离子晶体,含有离子键,故D错误,
故选C.
点评 本题考查位置结构性质关系综合应用,推断元素是解题关键,侧重对元素周期律的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 、 防治高血压 | B. |  防治缺铁性贫血 | ||
| C. |  做甜味剂 | D. | 、 火腿中加有防腐剂亚硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2?2SO3△H=-196.6kJ•mol-1 | |
| B. | C(g)+O2(g)=2CO△H=393.5kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ | |
| D. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
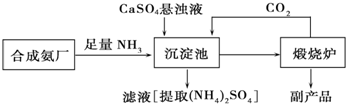
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据甲烷分子中四个键的键角相等,就可推知甲烷为正四面体结构 | |
| B. | 分子式为C4H8的烯烃与氢气加成反应后得到的烷烃有3种 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 苯中无碳碳双键,化学性质稳定,不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取蒸馏水和用海水晒盐都利用了相同的物质分离方法 | |
| B. | 往盛有少量淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有“银镜”出现 | |
| C. | 受强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| D. | 采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,可换算成反应物在不同反应时刻的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙中均一定含有离子键 | |
| B. | 丙中元素Y可用AgNO3溶液直接检验 | |
| C. | 离子半径大小为X2-<Y-<Z+ | |
| D. | 酸性条件下,丙的氧化性一定比乙强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦⑧ | B. | ①②⑤④③⑥⑦⑧ | C. | ①②⑤④③⑦⑥⑧ | D. | ⑥⑤④③②①⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com