

| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
| ||
| △t |
| 1 |
| 2 |
| ||
| 5min |
| 0.005×0.0153 |
| 0.005×0.015 |
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 800℃时,在2L密闭容器中发生2NO(g)+O2(g)?2NO2(g),测得n(NO)随时间的变化如下表:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)?2NO2(g),测得n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
科目:高中化学 来源: 题型:
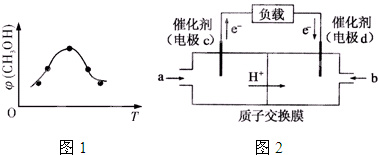
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据装置图,回答有关问题.
根据装置图,回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠保存在煤油中 |
| B、存放FeSO4溶液时加入少量铁粉 |
| C、NaOH溶液保存在带橡胶塞的玻璃试剂瓶中 |
| D、FeCl3溶液保存在广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该物质只具有氧化性 |
| B、该物质的摩尔质量是152 |
| C、15.2g该物质含有6.02×1023个原子 |
| D、该物质既有氧化性又有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com