
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX<HY | |
| B. | 若a=b,并测得c(X-)=c(Y-)+c(HY),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY | |
| D. | 若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1 mol/L |
分析 A.相同浓度的钠盐溶液,溶液的碱性越强,则该酸的酸性越弱;
B.若a=b,并测得c(X-)=c(Y-)+c(HY),说明相同浓度时HX的电离程度大于HY;
C.若a>b,测得c(X-)=c(Y-),说明HX的电离程度小于HY;
D.如果两种溶液等体积混合,溶液体积增大一倍,则浓度降为原来的一半.
解答 解:A.相同浓度的钠盐溶液,溶液的碱性越强,则该酸的酸性越弱,所以若a=b,pH(NaX)>pH(NaY),说明HX的酸性小于HY,所以则相同浓度时,酸性HX<HY,故A正确;
B.若a=b,并测得c(X-)=c(Y-)+c(HY),说明相同浓度时HX的电离程度大于HY,则相同浓度时,酸的电离程度越大其酸性越强,所以酸性HX>HY,故B正确;
C.若a>b,测得c(X-)=c(Y-),说明X-水解程度大于Y-,HX的电离程度小于HY,相同浓度时,酸性HX<HY,故C正确;
D.如果两种溶液等体积混合,溶液体积增大一倍,则浓度降为原来的一半,如果测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a+b=0.2mol/L,故D错误;
故选D.
点评 本题考查了盐类水解,根据相同浓度钠盐溶液pH大小确定酸的强弱,知道酸的强弱与酸浓度的关系是解本题关键,注意D中体积增大一倍时其浓度变化,但仍然遵循物料守恒,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.0g C2H6的中含有公用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时,pH=1的醋酸中H+含有的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=+-a kJ•mol-1,将2 NA 个CO与 NA 个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1 浓硫酸与足量铜微热反应生成 SO2分子数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有离子键的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 非金属原子间以共价键结合的物质都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过滤法除去Fe(OH)3胶体中的FeCl3 | |
| B. | 用25mL碱式滴定管量取20.10mLNa2CO3溶液 | |
| C. | 将SO2通入酸性KMnO4溶液中,可证明SO2具有漂白性 | |
| D. | 欲鉴别AlC13溶液和AgNO3溶液,向2种待测液中分别滴加足量氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
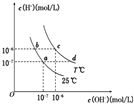 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑧ | B. | ①④⑦ | C. | ②⑤⑥⑧ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的还原性 | B. | 硫的氧化性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有2个N-H键断裂 | |
| B. | 3V正(N2)=V逆(H2) | |
| C. | 容器内混合气体的密度不再变化 | |
| D. | 容器内N2、H2、NH3的浓度比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子组 | 保留在溶液中的离子 |
| 1Zn2+和Al3+ | |
| 2Zn2+和Mg2+ | |
| 3Zn2+和Ba2+ | |
| 4Fe3+和Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com