
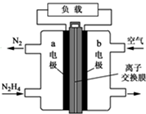
 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:分析 ①燃料电池的正极是氧气在正极发生还原反应,是负极发生氧化反应,是肼在反应,注意电解质溶液的酸碱性即可;
②原电池中阴离子移向负极;
③据负极电极反应式计算消耗燃料肼的质量.
解答 解:①燃料电池的正极是氧气在正极发生还原反应,负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,
故答案为:空气或氧气;N2H4+4OH--4e-=N2+4H2O;
②原电池中阴离子移向负极,a为负极,所以电池工作时,OH-移向a电极,
故答案为:a;
③负极电极反应式为N2H4+4OH--4e-=4H2O+N2↑,转移4mol电子时消耗肼32g,则转移5mol电子消耗肼32g×$\frac{5}{4}$=40g,
故答案为:40.
点评 本题考查了原电池原理的应用,题目难度中等,侧重于考查学生对原电池原理的应用能力,注意把握燃料电池的电极的判断方法和电极方程式的书写方法,


科目:高中化学 来源: 题型:选择题
| A. | 11.2 L NH3中所含的原子数为2NA | |
| B. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
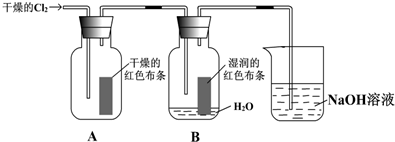
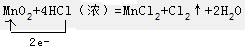
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
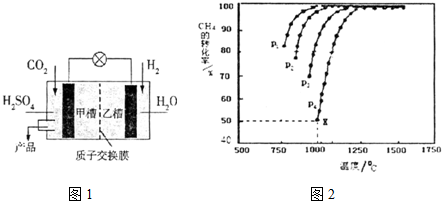 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com