
常温下,铝和铁在浓硝酸中“钝化”是化学变化吗?
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.乙烯和苯都能使溴水层褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( ) 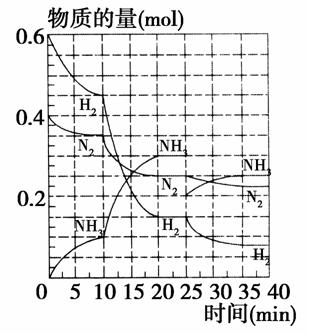
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
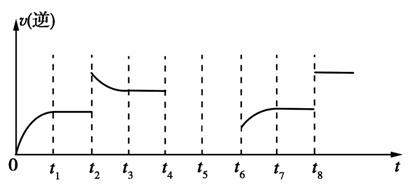
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2—→2NO+2O,②2NO+O2—→2NO2,③O+O2—→O3。下列对该反应过程及生成物叙 述正确的是 ( )
述正确的是 ( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
A.0.448 L B.0.672 L
C.0.896 L D.0.224 L
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组同学设计如下图所示装置探究氨气的还原性。

(1)氨催化氧化的化学方程式为_____________________________________________
________________________________________________________________________。
(2)若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为__________。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合适的方案并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2 3CO2+N2O。下列关于N2O的说法正确的是 ( )
3CO2+N2O。下列关于N2O的说法正确的是 ( )
A .上述反应中每生成1 mol N2O,消耗1.5 mol CO
.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3物质结构与性质](15分)
X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应:
2W+XZ2  X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
A、离子晶体 B、分子晶体 C、原子晶体 D、金属晶体
(4)基态T原子的核外电子排布式为 。
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
① [T(NH3)n]+中n= 。
② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。
 (6)化合物WZ和NaCl的晶胞结构形似
(6)化合物WZ和NaCl的晶胞结构形似
(氯化钠晶胞结构如右图所示)。
①在WZ中,阳离子和阴离
子的配位数均为 。
②已知WZ的密度为a g/cm3,
则WZ中距离最近的阳离子间的距离为
pm(用含a的算式表示,阿伏伽德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com