
【题目】室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
【答案】C
【解析】
试题分析:A.a点溶液是Al2(SO4)3,,溶液呈酸性的原因是Al3+水解,Al3+水解消耗水电离产生的OH-,破坏了水的电离平衡,水会继续电离,当最终达到平衡时,由于c(H+)>c(OH-),所以溶液显碱性,离子方程式为:Al3++3H2O![]() Al(OH)3 +3H+,错误;B.a~b段,随着NaOH溶液的不断滴入,OH-会中和水解产生的H+,使盐的水解程度增大,所以溶液中Al3+浓度减小,而溶液的pH增大,错误;C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀,正确;D.在d点时,NaOH过量,溶液是NaAlO2和NaOH的混合溶液,错误;故答案选C。
Al(OH)3 +3H+,错误;B.a~b段,随着NaOH溶液的不断滴入,OH-会中和水解产生的H+,使盐的水解程度增大,所以溶液中Al3+浓度减小,而溶液的pH增大,错误;C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀,正确;D.在d点时,NaOH过量,溶液是NaAlO2和NaOH的混合溶液,错误;故答案选C。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:
(1)E是 ;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号) 。
a.![]() b.
b.![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)

a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中 曲线(填写序号) 。
(5)②中C与D溶液等体积混合后溶液呈酸性的原因 (用离子方程式表示);若室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是:
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是:
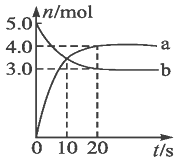
A.0-20 s内平均反应速率v(N2O5)=0.1 mol·L-1·s-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是

A.在任何溶液中,若有 CaSO4沉淀析出,则c(Ca2+) 与c(SO42-)一定相等
B.d点溶液通过蒸发可以变到c点
C.a点对应的Ksp等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol·L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度,请填写下列空白:
(1)将10.00 mL过氧化氢溶液移取至250mL (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
MnO4-+ H2O2+ H+= Mn2++ H2O+______( )
(3)移取10mL过氧化氢溶液可以用 (填“酸式”或“碱式”)滴定管。滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的浓度为 。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗。则测定结果 (填“偏高”“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 2mol/ L100ml的盐酸和锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H2O![]() CH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
CH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.混合溶液pH>7
B.对混合溶液进行微热,K1增大、K2减小
C.调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com