
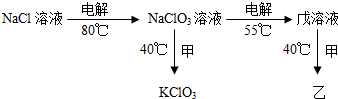
 ��Ԫ�صij������ϼ���-1��0��+1��+3��+4��+5��+7��
��Ԫ�صij������ϼ���-1��0��+1��+3��+4��+5��+7��| �������ʵ�ʲ��� |
| ���۲��� |
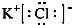 �� ��������������ڸ����·ֽ������Ȼ��غ������֪����������ȶ���ǿ������أ�����KClO3��KClO4���ʴ�Ϊ��
�� ��������������ڸ����·ֽ������Ȼ��غ������֪����������ȶ���ǿ������أ�����KClO3��KClO4���ʴ�Ϊ��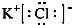 ��KClO3��KClO4��
��KClO3��KClO4��
| ||
| ||
| 80�� |
| 117g |
| 58.5g/mol |
| 1.6mol |
| 2mol |
| ||
| 80�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��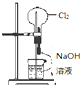 �� ����ѹ��ͷ�ιܺ�ῴ����ƿ���γ���Ȫ |
B��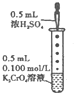 �μӼ���ŨH2SO4����Һ��ɫ�ɻ�ɫ��Ϊ��ɫ |
C��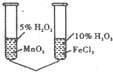 �ɸ�ʵ�������֤�����Ĵ�Ч�� |
D��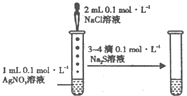 ����֤AgCl������ת��Ϊ�ܽ�ȸ�С��Ag2S���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� |
B�� |
C�� |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Ķ���̼��Һ�����ˮ�� |
| B������ˮ��������� |
| C�����ˮ��Ӿƾ��� |
| D�������ú����Һ��Ӽױ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ƥ�����ƹ�����ʹ�õ�K2Cr2O7��ʹ���������� |
| B����������Ҫ�ɷ��ǵ����� |
| C�������Խ���ҵ���������̷�������̷��е����ʵĺ��� |
| D��ʳ�����������������ԭ���ȣ�������ʳƷ���Ӽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3�� | B��6�� | C��2�� | D��4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCO3-��CO2 |
| B��FeO��Fe3O4 |
| C��KClO3��KCl |
| D��MnO4-��Mn2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com