

分析 (1)L层电子数与最外层电子数之比为4:1,d轨道中的电子数与最外层电子数之比为5:1,该元素位于第四周期可知该元素为Zn,根据锌的原子序数和构造原理来书写基态Zn原子的核外电子排布式;
(2)根据等电子原理来书写CO的结构式;
(3)利用氢键来解释物质的沸点;
(4)根据结构示意图中氧原子是否都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析;
(5)同主族从上到下原子半径依次增大,氢化物的稳定性同主族从上到下非金属性减弱,氢化物稳定性减弱,NH3含有氢键,沸点最高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高.
解答 解:(1)L层电子数与最外层电子数之比为4:1,L层不是最外层电子数为8,那么最外层电子数为2.d轨道中的电子数与最外层电子数之比为5:1,说明d轨道中的电子数为10.该元素位于第四周期可知该元素为Zn,
故答案为:Zn;1s22s22p63s23p63d10或[Ar]3d10;
(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为N≡N,互为等电子体分子的结构相似,则CO的结构式为C≡O,
故答案为:C≡O;
(3)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;
故答案为:甲醇分子之间形成氢键;
(4)A.氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同.从现代物质结构理论出发,硫酸根离子中S和非羟基O之间除了形成1个σ键之外,还形成了反馈π键.形成π键的电子不能处于杂化轨道上,O必须保留未经杂化的p轨道,就不可能是sp3杂化,故A错误;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确;
故答案为:B,D;
(5)N,P,As 属于第ⅤA族,同主族从上到下原子半径依次增大,氢化物的稳定性同主族从上到下非金属性减弱,氢化物稳定性减弱,所以稳定性 NH3>PH3>AsH3,
NH3含有氢键,沸点最高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高,故熔沸点:NH3>AsH3>PH3,
故答案为:沸点 NH3>AsH3>PH3,理由:NH3分子间形成氢键,AsH3相对分子质量大.稳定性 NH3>PH3>AsH3,理由:N,P,As 从上到下非金属性依次减弱,气态氢化物的稳定性依次减弱.
点评 本题主要考查核外电子排布式、等电子体原理、分子间作用力、杂化轨道、共价键类型、氢化物稳定性、溶沸点的比较等知识,注重了对物质结构中常考考点的综合,易错点在电子排布中3d与4s的书写上及杂化类型的判断上、NH3分子间形成氢键,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、AlO2-、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、ClO- | D. | Al3+、CH3COO-、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
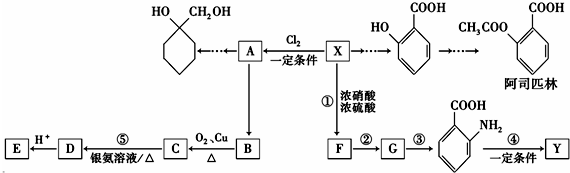

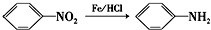 (苯胺,易被氧化)
(苯胺,易被氧化)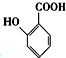 中官能团名称为酚羟基、羧基;
中官能团名称为酚羟基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O; 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2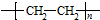
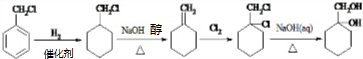 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
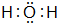 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中一定存在化学键 | |
| B. | 已知晶胞的组成就可推知晶体的组成 | |
| C. | 分子晶体在晶体态或熔融态下均不导电 | |
| D. | 原子晶体中只存在共价键,不可能存在其他类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
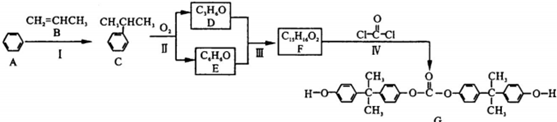
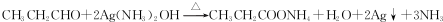 .
.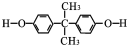 .
. 的反应合成航天用聚芳酯高分子,该化学反应方程式为
的反应合成航天用聚芳酯高分子,该化学反应方程式为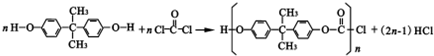 .
.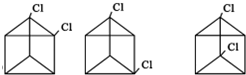 任意2种(任写两种).
任意2种(任写两种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com