
分析 (1)H2的标准燃烧热的热化学方程式为:①H2(g)+$\frac{1}{2}$O2?H2O(l)△H=-285.8kJ•mol-1;
CH2=CH2的标准燃烧热的热化学方程式为:②CH2=CH2(g)+3O2?2CO2(g)+2H2O(l)△H=-1411.0kJ•mol-1;
③H2O(g)?H2O(l)△H=-44kJ•mol-1;
根据盖斯定律可知,①×6-②-③×4可得2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);
(2)△H-T△S<0时反应自发进行;
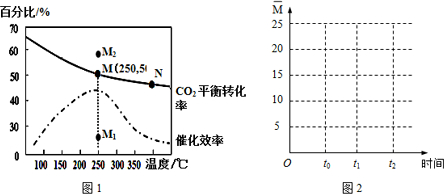
(3)由图可知,250℃时CO2的平衡转化率为50%,利用三段式求出平衡时的浓度,再根据平衡常数表达式计算;
(4)a.该反应正方向为放热反应,升高温度逆向移动;
b.温度越高,反应物活化分子百分数越大;
c.根据图象分析;
d.增大H2的量,CO2的平衡转化率增大;
e.混合气体的质量不变,体积不变,所以混合气体的密度始终不变;
(5)反应前混合气体的平均相对分子质量=$\frac{44×2+2×6}{2+6}$=12.5,随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,t1时将容器体积瞬间扩大至2V L,平衡向逆方向移动,t2时重新达平衡.
解答 解:(1)H2的标准燃烧热的热化学方程式为:①H2(g)+$\frac{1}{2}$O2?H2O(l)△H=-285.8kJ•mol-1 ;
CH2=CH2的标准燃烧热的热化学方程式为:②CH2=CH2(g)+3O2?2CO2(g)+2H2O(l)△H=-1411.0kJ•mol-1;
③H2O(g)?H2O(l)△H=-44kJ•mol-1;
根据盖斯定律可知,①×6-②-③×4可得2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)
△H=6(-285.8kJ•mol-1 )-(-1411.0kJ•mol-1)-4(-44kJ•mol-1)=-127.8kJ/mol;
故答案为:-127.8;
(2)由CO2合成CH2=CH2的反应,2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H=-127.8kJ/mol,该反应△H<0,△S<0,△H-T△S<0时反应自发进行,所以低温下反应自发进行;
故答案为:低温;该反应的△H<0,△S<0;
(3)由图可知,250℃时CO2的平衡转化率为50%,则
2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)
起始浓度(mol/L):1 3 0 0
转化浓度(mol/L):0.5 1.5 0.25 1.0
平衡浓度(mol/L):0.5 1.5 0.25 1.0
平衡常数K=$\frac{1.{0}^{4}×0.25}{0.{5}^{2}×1.{5}^{6}}$=0.088;
故答案为:0.088;
(4)a.该反应正方向为放热反应,升高温度逆向移动,N点的温度大于M点,所以M点反应向正方向进行的程度大,即平衡常数大小:M>N,故a正确;
b.温度越高,反应物活化分子百分数越大,N点的温度高,所以反应物活化分子百分数大小:M<N,故b错误;
c.由图象可知,其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M,故c错误;
d.增大H2的量,CO2的平衡转化率增大,所以其他条件不变,若投料改为4mol H2和1mol CO2时,则250℃时CO2的平衡转化率可能位于点M2,故d正确;
e.混合气体的质量不变,体积不变,所以混合气体的密度始终不变,所以不能根据混合气体的密度来判断化学反应是否达到平衡状态,故e错误;
故答案为:a、d;
(5)反应前混合气体的平均相对分子质量=$\frac{44×2+2×6}{2+6}$=12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量=$\frac{28+18×4}{1+4}$=20,则t0达平衡时$\overline{M}$应在区间(12.5,20),t1时将容器体积瞬间扩大至2V L,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时 $\overline{M}$应大于12.5,所以图象为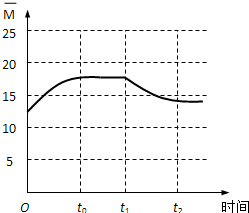 ,
,
故答案为: .
.
点评 本题考查本题考查了盖斯定律、化学平衡移动的影响因素、化学平衡计算等,注意把握盖斯定律的应用方法、三段式在化学平衡计算中的灵活应用是解题的关键,侧重于考查学生对基础知识的综合应用能力、计算能力和画图能力,题目难点中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
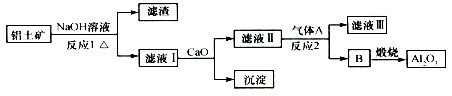
| A. | 气体A一定为HCl | B. | 滤液Ⅰ中溶质可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸钙 | D. | 反应1、反应2均是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
| A. | 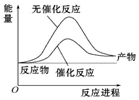 如图可表示合成氨过程中的能量变化 | |
| B. | a的数值为391 | |
| C. | Q1的数值为92 | |
| D. | 相同条件下,反应物若为2 mol N2和6 mol H2,放出热量Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
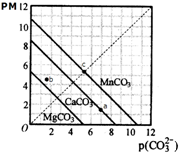
| A. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| B. | b点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) | |
| C. | c可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) | |
| D. | MgCO3、CaCO3、MnCO3的Ksp依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
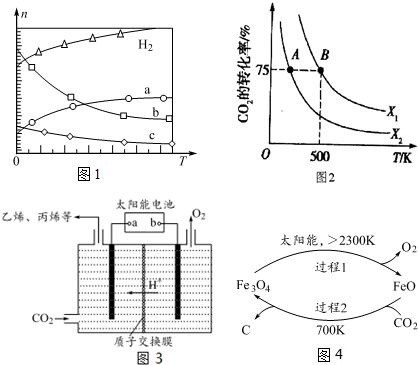
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com