
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| D. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 |
分析 A.碘以离子存在,需要氧化;
B.加热至170℃发生消去反应;
C.水与电石反应较快;
D.发生吸氧腐蚀时,正极上氧气得到电子.
解答 解:A.碘以离子存在,需要氧化,则实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取,故A错误;
B.加热至170℃发生消去反应,则不能用水浴加热,故B错误;
C.水与电石反应较快,则用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率,故C正确;
D.发生吸氧腐蚀时,正极上氧气得到电子,则被腐蚀的速率与氧气浓度有关,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、物质的制备、反应速率、电化学腐蚀为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 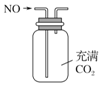 用图所示装置(正放)可收集NO气体 | |
| B. | 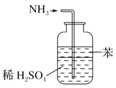 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 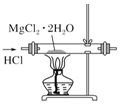 用装置制取无水MgCl2 | |
| D. | 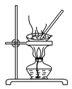 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 描述一 | 描述二 | |
| A | 淀粉和纤维素互为同分异构体 | 乙酸和乙酸乙酯互为同系物 |
| B | 金刚石和石墨互为同素异形体 | O2和O3互为同位素 |
| C | SO2和NO2都属于大气污染物 | pH小于7的雨水就属于酸雨 |
| D | 正反应活化能小于逆反应活化能的反应属于放热反应 | 反应物能量总和大于生成物能量总和的反应属于放热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com