
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出标准状况下5.6L氧气的物质的量,然后根据m=nM计算出二氧化碳的质量,再根据N=nNA计算出含有分子、原子的说明,据此进行解答;
(2)①根据M=ρVm可知,相同条件下气体密度与摩尔质量成正比;
②两个容器中气体密度相等,则含有的气体的质量相同,容器中压强与气体的物质的量成正比;
③根据c=$\frac{1000ρω}{M}$可知,两种溶液的质量分数相同时,物质的量浓度之比与密度成正比、与摩尔质量成反比,据此进行计算两种溶液的物质的量浓度之比.
解答 解:(1)标准状况下5.6L二氧化碳的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,0.25mol二氧化碳的质量为:44g/mol×0.25mol=11g,含有二氧化碳分子的数目为0.25NA,
0.25mol二氧化碳分子中含有原子的物质的量为:0.25mol×3=0.75mol,含有原子的数目为0.75NA,
故答案为:11;0.25NA;0.75NA;
(2):①相同条件下,M、N气体的密度之比与其摩尔质量成正比,所以二者的密度之比为:2:1,
故答案为:2:1;
②两个容器中气体的密度相同,则气体的质量相等,物质的量与摩尔质量成反比,而压强与气体的物质的量成正比,则容器中气体的压强与摩尔质量成反比,两个容器中压强之比为:1:2
故答案为:1:2;
③两种溶液的质量分数相同时,由c=$\frac{1000ρω}{M}$可知,溶液的物质的量浓度与$\frac{ρ}{M}$成正比,所以两种溶液的物质的量浓度之比为:$\frac{{d}_{1}}{M}$:$\frac{{d}_{2}}{N}$=d1:2d2,
故答案为:d1:2d2.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量、气体摩尔体积之间的关系即可解答是,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨时选择500℃ | |
| B. | 配制FeCl3溶液时加入少量的盐酸 | |
| C. | 在Na2CO3溶液中,由水电离出的c(OH-)>1×10-7mol/L | |
| D. | AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液,反应后进行过滤、洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
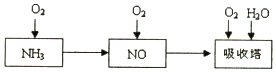
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
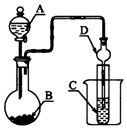
| A. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| B. | 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 | |
| D. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com