
| A. | Na2CO3 NaHCO3 CH3COONa NaF | |
| B. | NaHCO3 Na2CO3 CH3COONa NaF | |
| C. | NaF CH3COONa Na2CO3 NaHCO3 | |
| D. | NaF CH3COONa NaHCO3Na2CO3 |
分析 根据各酸的电离平衡常数可知酸性强弱为:HF>CH3COOH>H2CO3>HCO3-,酸性越强,对应酸根离子的水解程度越弱,溶液碱性越弱,溶液的pH越小,据此进行解答.
解答 解:已知Ka(CH3COOH)=1.7×10-5,Ka1(H2CO3)=4.2×10-7,Ka2(H2CO3)=5.6×10-11,Ka(HF)=6.8×10-4,则酸性强弱为:HF>CH3COOH>H2CO3>HCO3-,则盐的水解程度大小为:Na2CO3>NaHCO3>CH3COONa>NaF,水解程度越大,溶液pH越大,
所以物质的量浓度相同的下列溶液中,按pH由小到大的顺序排列为:NaF<CH3COONa<NaHCO3<Na2CO3,
故选D.
点评 本题考查了盐的水解原理的应用、溶液pH的大小比较,题目难度不大,明确盐的水解原理为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | W | |||
| Y | Z |
| A. | X元素形成的氢化物液态比固态的密度小 | |
| B. | 四种元素行成的简单离子半径从大小的排列顺序Y>Z>X>W | |
| C. | 常温下,Y形成的简单离子和W形成的简单离子在水溶液中可以大量共存 | |
| D. | Y常用于冶炼难熔的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水或水溶液中25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | NaOH溶液在25℃时,c(H+)•c(OH-)>1×10-14 | |
| D. | 溶液浓度改变或酸碱度改变,Kw随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO42-、K+、Cl- | B. | CH3COO-、Na+、Cl-、NH4+ | ||
| C. | CH3COO-、Na+、OH-、K+ | D. | K+、SO42-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的最简式:C6H6 | B. | 乙烯分子的结构简式为:CH2CH2 | ||
| C. | 一氯甲烷的电子式为: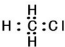 | D. | 2-甲基丁烷的键线式: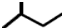 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com