
| A. |  甲能使酸性高锰酸钾溶液褪色 | |
| B. |  乙可与溴水发生加成反应使溴水褪色 | |
| C. |  丙中的碳碳键是碳碳单键和碳碳双键交替结合 | |
| D. |  丁在Cu催化作用下可与氧气发生取代反应 |
分析 由图可知,甲为甲烷,乙为乙烯,丙为苯,丁为乙醇.
A.甲烷性质稳定,与高锰酸钾不反应;
B.乙烯中含双键,可与溴水发生加成反应;
C.苯不含碳碳双键;
D.乙醇可发生催化氧化.
解答 解:由比例模型可知四种常见有机物分别为甲烷、乙烯、苯、乙醇,
A.甲烷的化学性质稳定,不能使酸性KMnO4溶液褪色,故A错误;
B.乙烯中含有碳碳双键,可与溴水发生加成反应而使溴水褪色,故B正确;
C.苯中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键,故C错误;
D.乙醇在Cu催化作用下可与氧气发生催化氧化,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握比例模型及对应化合物的性质为解答的关键,侧重常见几种烃和乙醇性质及结构的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
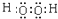
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极,Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量减少 | |
| C. | 在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移 | |
| D. | 该电池工作时,X极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性次序为c>b | |
| B. | c和d形成的化合物存在离子键 | |
| C. | 最高价氧化物对应水化物的酸性:c>b | |
| D. | 离子半径:d+>c- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
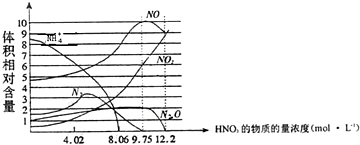
| A. | 一般来说,硝酸与铁反应的还原产物不是单一的 | |
| B. | 用一定量的铁粉与大量的9.75mol•L-1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol. | |
| C. | 硝酸的浓度越大,其还原产物中价态越高的成份越多 | |
| D. | 当硝酸浓度为9.75mol•L-1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过氧化钠除去CO气体中混有的少量CO2 | |
| B. | 用酸性KMnO4溶液可以检验CH2=CHCH2OH中是否含有碳碳双键 | |
| C. | 用乙醚萃取青蒿中青蒿素时使用的主要仪器是分液漏斗 | |
| D. | 在滴定实验中,量取待测液的滴定管未用待测液润洗,会使测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
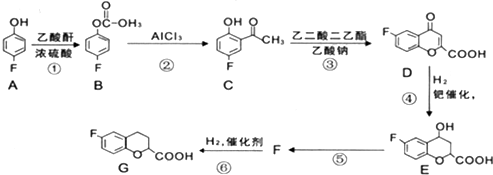
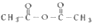 ,请回答下列问题:
,请回答下列问题: .
. (写结构简式,一种即可).
(写结构简式,一种即可). 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com