
| A、电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA |
| B、标准状况下,44.8L NO与22.4L O2混合后气体中分子总数等于2NA |
| C、1mol Fe在氧气中充分燃烧失去3NA个电子 |
| D、NO2和H2O反应每生成2mol HNO3时转移的电子数目为2NA |
| 8 |
| 3 |
| 8 |
| 3 |
| 8 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、P2O5能与水反应,可用于干燥氨气 |
| B、MgO是一种电解质,工业上常用电解MgO冶镁 |
| C、福尔马林具有防腐杀菌效果,可用于浸制生物标本 |
| D、PbO2具有氧化性和导电性,可用作铅蓄电池负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、页岩气是从页岩层中开采出来的天然气.产气页岩分布广、厚度大,且普遍含气,故可以成为提供廉价而充足的新型燃料来源 |
| B、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| C、目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 |
| D、竹炭具有超强的吸附能力,能吸附新装修房屋内的所有有害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
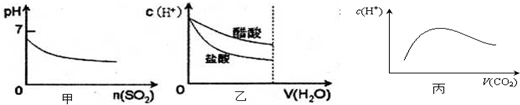
| A、甲是向溴水通入S02气体时,pH与S02物质的量的关系图 |
| B、乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C、常温常压下,将2b mol CO2气体通入1L b mol?L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、向H2O中投入少量Na218O2固体:2H2O+2Na218O2═4Na++418 OH-+O2↑ |
| D、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、0.1mol?L-1 FeCl3溶液:NH4+、H+、I-、SCN- | ||
| C、0.1mol?L-1 Na2CO3溶液:K+、Ca2+、HCO3-、SO42- | ||
| D、使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁 |
| B、炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去 |
| C、炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材 |
| D、电解铝时阴极材料需要定期更换. |
查看答案和解析>>
科目:高中化学 来源: 题型:
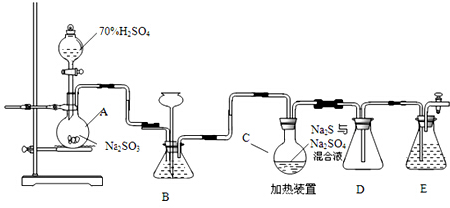
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
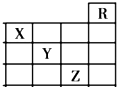 如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com