
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作正确 | |
| C. | 滴定前无气泡,滴定终了有气泡 | |
| D. | 配制标准溶液的Na0H中混有Na20杂质 |
分析 用标准的NaOH溶液滴定未知浓度的盐酸,先分析不当操作对消耗的标准溶液体积的影响,再根据c(酸)=$\frac{c(碱)V(碱)}{V(酸)}$分析滴定误差;等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏大;等质量的氢氧化钠和Na2O消耗的酸后者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏小,据此进行解答.
解答 解:A.配制标准溶液的NaOH中混有Na2CO3杂质,以酚酞为指示剂时等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏大,根据c(酸)=$\frac{c(碱)V(碱)}{V(酸)}$分析可知c(酸)偏高,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致标准液的体积读数偏小,则测定结果偏低,故B错误;
C.滴定前无气泡,滴定终了有气泡,导致消耗的标准液体积偏小,测定结果偏低,故C错误;
D.配制标准溶液的Na0H中混有Na20杂质,等质量的氢氧化钠和Na2O消耗的酸后者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏小,测定结果偏低,故D错误;
故选A.
点评 本题考查中和滴定的误差分析,题目难度中等,明确中和滴定操作方法为解答关键,注意根据操作方法对c(酸)=$\frac{c(碱)V(碱)}{V(酸)}$的影响分析,若标准溶液的体积偏小,那么测得的物质的量的浓度也偏小;若标准溶液的体积偏大,那么测得的物质的量的浓度也偏大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
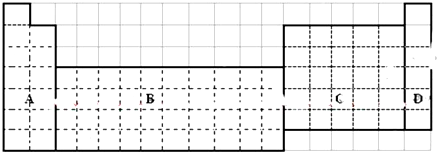
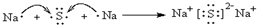 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
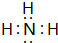 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程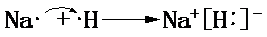 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
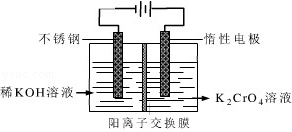 铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.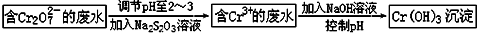
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
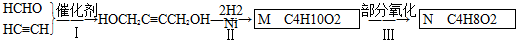
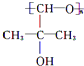

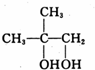 ,B中的官能团名称是醛基和醇羟基.
,B中的官能团名称是醛基和醇羟基.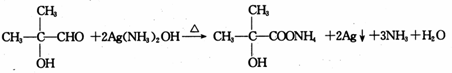 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com