
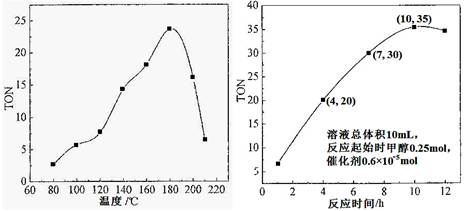
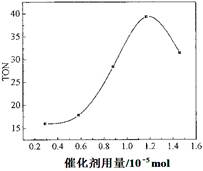
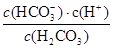 ��Ka=10-6.1mol?L-1������ѪҺ��c��HCO3-����c��H2CO3����20��1����c��H+��=10-7.4mol?L-1����pH��7.4��
��Ka=10-6.1mol?L-1������ѪҺ��c��HCO3-����c��H2CO3����20��1����c��H+��=10-7.4mol?L-1����pH��7.4��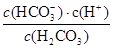 ��10-6.1��ѪҺ��ƷpHΪ7.4����c��H+��=10-7.4mol/L������
��10-6.1��ѪҺ��ƷpHΪ7.4����c��H+��=10-7.4mol/L������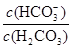 ��10?6.1��10?7.4��101.3�����ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪc(HCO3-)��c(H2CO3)��c(OH-)��c(H+)��
��10?6.1��10?7.4��101.3�����ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪc(HCO3-)��c(H2CO3)��c(OH-)��c(H+)�� HCO3-+H+ƽ�⣬������ǿʱ��ѪҺ��������Ũ��������ƽ�������ƶ���������ǿʱ����������Ũ������ƽ�������ƶ�����˿���ά��ѪҺ��pH�ȶ���
HCO3-+H+ƽ�⣬������ǿʱ��ѪҺ��������Ũ��������ƽ�������ƶ���������ǿʱ����������Ũ������ƽ�������ƶ�����˿���ά��ѪҺ��pH�ȶ���


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol ���¶�T1��T2ʱ���ֱ�0��50 mol CH4��1��2 mol NO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±���
N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol ���¶�T1��T2ʱ���ֱ�0��50 mol CH4��1��2 mol NO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±���| �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0��50 | 0��35 | 0��25 | 0��10 | 0��10 |
| T2 | n(CH4) | 0��50 | 0��30 | 0��18 | ���� | 0��15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��
CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��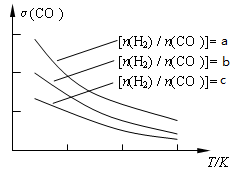
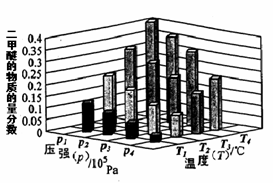
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| ��/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ������ָ��λʱ�����κ�һ�ַ�Ӧ�����ʵ����ļ��ٻ��κ�һ�����������ʵ��������� |
| B����ѧ��Ӧ����Ϊ0.8 mol /��L��s����ָ1s ʱij���ʵ�Ũ��Ϊ0.8mol/L |
| C�����ݻ�ѧ��Ӧ���ʵĴ�С����֪����ѧ��Ӧ���еĿ��� |
| D��������Ӧ���ʵ���Ҫ�����Ƿ�Ӧ���Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
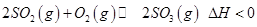 ���Ʊ��������Ҫ��Ӧ������˵����ȷ����
���Ʊ��������Ҫ��Ӧ������˵����ȷ����A�������������Ӧ���ʼӿ죬��Ӧ�� ��� ��� |
B����ƽ���Ļ��������Ũ�������գ�ʣ�������ֻ�� |
| C��98����Ũ�����õ������ˮϡ�ͺ��������������Ϊ49�� |
| D������ϡ����Ϊ���Һ�����÷�Ӧ��Ƴ�ԭ��أ��ŵ�����и���������Һ��pH���ϼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cQ(g)������M��N��Q�����ʵ�����ʱ��ı仯��ͼ��ʾ��������������ȷ����( )
cQ(g)������M��N��Q�����ʵ�����ʱ��ı仯��ͼ��ʾ��������������ȷ����( )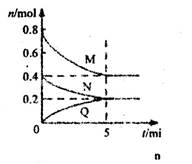
| A�����¶��´˷�Ӧ��ƽ�ⳣ����ֵK��25/4 |
| B���÷�Ӧǰ5 min��ƽ�����ʣ�v(N)��0.002 mol��L-1��min-1 |
| C����5 minʱ��������ϵ�г�������He�����´ﵽƽ��ǰv(��)��v(��) |
| D������ʼʱ�������г���2mol M��1mol N���ﵽƽ��ʱ��M���������С��50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
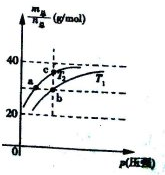
| A��ƽ�ⳣ��K(a)=K(b)<K(c) |
| B����Ӧ���ʣ�va<vb�� |
| C���¶ȣ�T2>T1 |
D����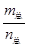 =69g/molʱ����n(NO2)��n(N2O4)=2��1�� =69g/molʱ����n(NO2)��n(N2O4)=2��1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ʵ���� | �����£��Թ��������Լ��������� / mL | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |

| ʵ���� | �����£��Թ��������Լ��������� / mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05 mol/L KMnO4��Һ | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com