
| A. | 氧化产物为Fe3O4和SiO2 | |
| B. | 氧化剂与还原剂物质的量的之比为2:3 | |
| C. | 当有1.5mol Fe2SiO4参加反应时,转移的电子为3 mol | |
| D. | 当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol |
分析 3Fe2SiO4+2CO2→2Fe3O4+3SiO2+2CO反应中,C元素的化合价降低,Fe元素的化合价升高,Si元素的化合价不变,据此分析.
解答 解:A、反应中Fe元素的化合价升高,Si元素的化合价不变,则氧化产物为Fe3O4,故A错误;
B、反应中CO2为氧化剂,Fe2SiO4为还原剂,3mol还原剂中只有$\frac{2}{3}$被氧化,则氧化剂与还原剂物质的量的之比为1:1,故B错误;
C、当有3mol Fe2SiO4参加反应时,转移的电子为4 mol,则有1.5mol Fe2SiO4参加反应时,转移的电子为2 mol,故C错误;
D、1molFe2SiO4失去2mol电子,1mol CO2得到2mol电子,所以当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol,故D正确.
故选D.
点评 本题考查了氧化还原反应,题目难度不大,注意根据化合价的变化分析解答,侧重于考查学生对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C3H4 | D. | C2H4和C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的元素符号为S | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 可以与H2化合生成气态化合物 | |
| D. | 其轨道表示式为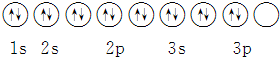 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别点燃,有黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,上、下两层红棕色均消失的是己烯 | |
| C. | 分别加入溴水振荡,静置后分层,下层红棕色消失的是己烯 | |
| D. | 分别加入酸性高锰酸钾溶液,振荡,静置后水层紫色消失的是己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
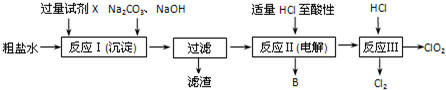
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
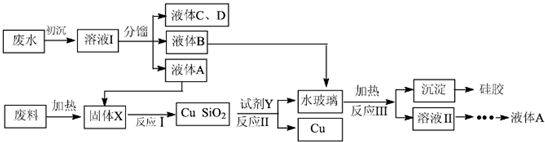
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
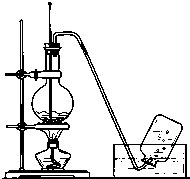 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com