
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
分析 (1)(NH4)2SO4和NH4HSO4固体混合物中加入氢氧化钠溶液,首先氢离子与氢氧化钠溶液发生中和反应,然后铵根离子与氢氧根离子加热反应生成氨气,据此写出反应的离子方程式;
(2)由数据Ⅰ和Ⅱ判断此时氢氧化钠过量,样品步骤,生成氨气的体积与样品的质量成正比,据此计算出3.7g样品生成氨气的体积;
(3)Ⅱ中样品完全反应,设出(NH4)2SO4和NH4HSO4的物质的量,然后根据氨气的物质的量、样品质量列式计算出二者的物质的量,再计算出二者的物质的量之比;
(4)根据Ⅲ组数据中进入22.2g样品只生成了1.12L氨气可知,此时氢氧化钠溶液不足,可以根据Ⅲ中数据计算出氢氧化钠溶液浓度;
先根据(3)计算出22.2g样品中含有的NH4HSO4物质的量,再根据反应的先后顺序H++OH-=H2O,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O计算出氢氧化钠的物质的量,最后根据c=$\frac{n}{V}$计算出氢氧化钠的物质的量浓度.
解答 解:(1)(NH4)2SO4和NH4HSO4固体混合物中加入氢氧化钠溶液后加热发生的反应有:氢离子与氢氧根离子反应生成水:H++OH-=H2O、铵根离子与氢氧根离子在加热条件下反应生成氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:H++OH-=H2O、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)由Ⅰ和Ⅱ中的数据7.4 g:1.68 L=14.8 g:3.36 L可知:当样品质量≤14.8 g时,NaOH足量,即样品质量与氨气体积比为定值,则3.7g样品生成氨气的体积为:V(NH3)=$\frac{3.7g}{7.4g}$×1.68 L=0.84 L,
故答案为:0.84;
(3)设 (NH4)2SO4、NH4HSO4物质的量分别为x、y,则:①2x+y=$\frac{1.68L}{22.4L/mol}$=0.075mol,②132x+115y=7.4g,
根据①②联立解得:$\left\{\begin{array}{l}{x=0.0125mol}\\{y=0.05mol}\end{array}\right.$,
所以:n[(NH4)2SO4]:n[NH4HSO4]=0.0125mol:0.05mol=1:4,
故答案为:1:4;
(4)根据表中数据可知,当Ⅲ中进入22.2g样品时,比Ⅱ生成的氨气体积小,说明氢氧化钠已经不足,可以根据Ⅲ计算出氢氧化钠溶液的浓度;
根据(3)可知,22.2g样品中含NH4HSO4物质的量为:0.05mol×$\frac{22.2g}{7.4g}$=0.15mol,反应的先后顺序为:H++OH-→H2O,NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
求得n(NaOH)=0.15mol+$\frac{1.12L}{22.4L/mol}$=0.2mol,
则氢氧化钠溶液的浓度为:c(NaOH)=$\frac{0.2mol}{0.04L}$=5mol/L,
故答案为:Ⅲ;22.2g样品中含NH4HSO4物质的量为:0.05mol×$\frac{22.2g}{7.4g}$=0.15mol,反应的先后顺序为:H++OH-→H2O,NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
求得n(NaOH)=0.15mol+$\frac{1.12L}{22.4L/mol}$=0.2mol,
则氢氧化钠溶液的浓度为:c(NaOH)=$\frac{0.2mol}{0.04L}$=5mol/L.
点评 本题考查了有关混合物的计算,题目难度较大,正确分析表中数据不能够判断过量情况为解答关键,注意掌握常见物质之间的反应原理,试题充分考查了学生的分析、理解能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: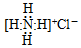 | |
| B. | 对硝基甲苯: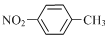 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾石墨是一类共价化合物 | B. | 钾石墨导电性比石墨强 | ||
| C. | 钾石墨遇水不产生氢气 | D. | C8K、C24K和C36K属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
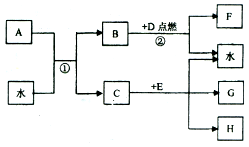 如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.
如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO-2、SO2-4 | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 镍镉可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2$?_{放电}^{充电}$Cd(OH)2+2Ni(OH)2+2H2O,充电时阳极反应为:Ni(OH)2+OH-+e-═NiO(OH)+H2O | |
| D. | 某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O.已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
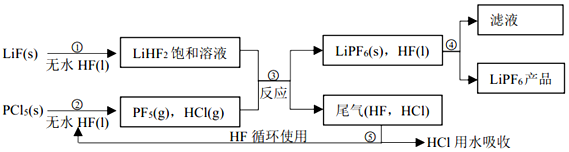
查看答案和解析>>
科目:高中化学 来源: 题型:实验题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com