
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
分析 实验1从开始到反应达到化学平衡时,氧气的变化量为:2mol-0.8mol=1.2mol,根据反应2SO2(g)+O2(g)?2SO3(g)可知,平衡时二氧化硫消耗的物质的量为:1.2mol×2=2.4mol,则平衡时二氧化硫的物质的量为:4mol-2.4mol=1.6,即x=1.6;
实验2平衡时二氧化硫消耗的物质的量为:4mol-0.4mol=3.6mol,根据反应2SO2(g)+O2(g)?2SO3(g)可知,平衡时氧气消耗的物质的量为:3.6mol×$\frac{1}{2}$=1.8mol,则平衡时氧气的物质的量为:2mol-1.8mol=0.2mol,即y=0.2;
反应起始量相同,达到平衡时氧气物质的量可知,实验2反应进行的程度大,反应是放热反应,温度越高,平衡向吸热反应方向进行,逆向进行,所以温度T1>T2,结合温度对化学平衡的影响及化学反应速率的表达式进行解答.
解答 解:实验1从开始到反应达到化学平衡时,氧气的变化量为:2mol-0.8mol=1.2mol,根据反应2SO2(g)+O2(g)?2SO3(g)可知,平衡时二氧化硫消耗的物质的量为:1.2mol×2=2.4mol,则平衡时二氧化硫的物质的量为:4mol-2.4mol=1.6,即x=1.6;
实验2平衡时二氧化硫消耗的物质的量为:4mol-0.4mol=3.6mol,根据反应2SO2(g)+O2(g)?2SO3(g)可知,平衡时氧气消耗的物质的量为:3.6mol×$\frac{1}{2}$=1.8mol,则平衡时氧气的物质的量为:2mol-1.8mol=0.2mol,即y=0.2;
A.根据分析可知,x=1.6,y=0.2;由于温度T1>T2,温度越低,反应速率越慢,则得达到平衡状态的时间越长,所以t>6,故A错误;
B.反应起始量相同,达到平衡时氧气物质的量可知,实验2反应进行的程度大,反应是放热反应,温度越高,平衡向吸热反应方向进行,逆向进行,所以温度T1>T2,故B正确;
C.根据C可知,温度T1>T2,该反应为放热反应,温度升高,平衡向着逆向移动,则反应物浓度增大、生成物浓度减小,平衡常数越小,所以平衡常数K2>K1,故C正确;
D.实验1在前6 min的反应速率v (SO2)=$\frac{\frac{2.4mol}{2L}}{6min}$=0.2 mol•L-1•min-1,故D正确;
故选A.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z>W;氢化物的沸点是Z<W | |
| D. | 还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
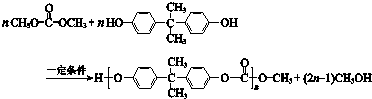
| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 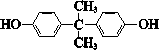 与 与 互为同系物 互为同系物 | |
| D. | 1 mol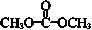 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁粉反应,反应转移电子的数目为3NA | |
| B. | 室温时,足量Zn与浓硫酸反应共产生2mol气体,转移电子数为4NA | |
| C. | 7.8gNa2O2与足量水反应时转移电子数目为0.2NA | |
| D. | 1mol二氧化氮气体久置后在标准状况下的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
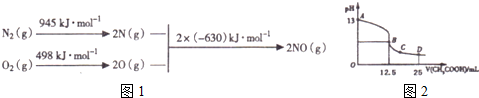
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br难溶于水 | |
| B. | 该反应属于取代反应 | |
| C. | CH3CH2Br与HBr均属于电解质 | |
| D. | 若原料完全反应生成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com