
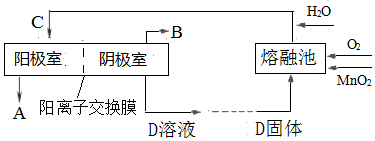
分析 (1)根据题干信息可知反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,根据原子守恒书写化学反应方程式,根据方程式可知3molK2MnO4参加反应生成2molKMnO4、1molMnO2,据此判断氧化剂与还原剂的质量之比;原电池的正极上发生得电子的还原反应;
(2)根据信息:软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4来书写方程式;电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,阳极MnO42-失去电子得到MnO4-;
(3)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b,据此计算回答.
解答 解:(1)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;锂离子有机高聚物、锂及MnO2构成原电池,正极上发生得电子的还原反应,电极反应式为:MnO2+e-+Li+=LiMnO2,
故答案为:1:2;MnO2+e-+Li+=LiMnO2;
(2)根据信息:软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4来书写方程式为:2MnO2+4KOH+O2$\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-═2MnO4-,即MnO42--e-=MnO4-,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+2H2O;KOH;MnO42--e-=MnO4-;
(3)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl2的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
点评 本题综合考查电解池的工作原理,方程式的书写以及电子守恒的计算知识,侧重于氧化还原反应知识的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1NA个NH3分子的质量为1.7g | |
| B. | 标准状况下,1mol氟化氢的体积为22.4L | |
| C. | 2.4g金属镁转化为镁离子时失去的电子数目为0.1NA | |
| D. | 1L 1mol/L NaCl溶液中含有的离子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖  的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的  最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g NO2(g)和N2O4(g)的混合物中含有0.3NA个原子 | |
| B. | 0.1mol乙酸与足量乙醇发生酯化反应,生成0.1NA个乙酸乙酯分子 | |
| C. | 常温下将5.6gFe投入足量浓硫酸,电子转移数为0.3NA | |
| D. | Na2O2与足量H2O发生反应,每生成2.24L气体(标准状况),电子转移数0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol SO2、O2的混合气体,充分反应达到平衡后体系内氧原子数目为0.2NA | |
| B. | 0.1 mol ${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 标准状况下,22.4 L空气中单质分子数目为NA | |
| D. | 100 g质量分数是98%的浓硫酸中所含氧原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与等量盐酸恰好中和时放出的热量:A=B | |
| B. | 与等量盐酸恰好中和时所得溶液的pH:A=B=C | |
| C. | a>10b | |
| D. | A和B相比,氨水A中$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下6.0g乙酸所含σ键数目为0.8NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mLl2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com