
| A. | Fe3+、OH- | B. | Na+、SO42- | C. | Ag+、Cl- | D. | H+、OH- |
分析 A.铁离子与氢氧根离子反应生成氢氧化铁沉淀;
B.钠离子不与硫酸根离子反应;
C.银离子与氯离子反应生成难溶物氯化银;
D.氢离子与氢氧根离子发生中和反应.
解答 解:A.Fe3+、OH-之间反应生成难溶物氢氧化铁,在溶液中不能大量共存,故A错误;
B.Na+、SO42-之间不反应,在溶液中能够大量共存,故B正确;
C.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故C错误;
D.H+、OH-之间反应生成水,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
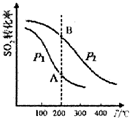 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
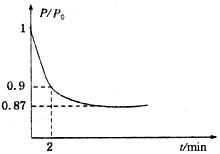 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com